
【題目】實驗室制取乙烯并檢驗乙烯性質的裝置如下圖。

請回答有關問題:
(1)燒瓶中除反應物以外,還應放2-3塊碎瓷片,目的是_________________;
(2)燒瓶中產生乙烯的反應方程式為:_________________,反應類型為:_________________;C中發生反應的化學方程式為:_________________,反應類型為:_________________;
(3)反應一段時間后,可觀察到D中的現象是:_________________;
(4)B中所裝的溶液是:_________________溶液,起的作用是_________________。
【答案】(1)防止暴沸 (2)CH3CH2OH![]() CH2=CH2↑+H2O 消去反應
CH2=CH2↑+H2O 消去反應
Br2+CH2=CH2→BrCH2CH2Br;加成反應 (3)酸性高錳酸鉀溶液褪色 (4)NaOH;除去制取乙烯氣體產生的雜質SO2和CO2等,避免影響乙烯的性質檢驗
【解析】
試題分析:(1)反應條件是加熱到170℃,因乙醇的沸點低,易暴沸,在圓底燒瓶中放2-3塊碎瓷片的目的是防止暴沸;
(2)利用乙醇在濃硫酸的催化作用下發生分子內脫水制取乙烯,乙醇發生消去反應,所以實驗室制取乙烯的化學方程式為CH3CH2OH![]() CH2=CH2↑+H2O,乙烯含有碳碳雙鍵,能和溴發生加成反應Br2+CH2=CH2→BrCH2CH2Br,生成1,2-二溴乙烷褪色;
CH2=CH2↑+H2O,乙烯含有碳碳雙鍵,能和溴發生加成反應Br2+CH2=CH2→BrCH2CH2Br,生成1,2-二溴乙烷褪色;
(3)乙烯分子中含有碳碳雙鍵,能使酸性高錳酸鉀溶液褪色,因此反應一段時間后,可觀察到D中的現象是:酸性高錳酸鉀溶液褪色;(4)反應中揮發出的乙醇、乙酸和其它副產物氣體(如乙醚、SO2和CO2等),干擾檢驗乙烯性質實驗,因此可用10%的NaOH溶液吸收。


科目:高中化學 來源: 題型:
【題目】(1)某科研小組研究:在恒溫、恒容(容器容積為2L,)下N2(g)+3H2(g)![]() 2NH3(g)反應的變化。初始條件n (H2)= 3mol 、n (N2)=1mol,反應達到平衡時H2的轉化率為60%,NH3的體積分數約為43%
2NH3(g)反應的變化。初始條件n (H2)= 3mol 、n (N2)=1mol,反應達到平衡時H2的轉化率為60%,NH3的體積分數約為43%
①此條件下反應的平衡常數K= 。
②若初始條件n (NH3)= 2mol,反應達到平衡時NH3的轉化率為 ,
③若初始條件n (H2)= 6mol 、n (N2) =2mol,反應達到平衡時NH3的體積分數 43%,此時移除0.5 mol NH3 ,再次達到平衡時NH3的體積分數 43% (填 “>、<、=”)
(2)N2O5是一種新型硝化劑,其性質和制備受到人們的關注。
一定溫度下,在恒容密閉容器中N2O5可發生下列反應:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表為該反應在T1溫度下的部分實驗數據
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
則500s內NO2的平均生成速率為 。
②現以NO2、O2、N2O5、熔融鹽NaNO3組成的燃料電池,采用電解法制備N2O5,裝置如圖所示。

寫出石墨I電極上發生反應的電極反應式 。
在電解池中生成N2O5的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值,下列說法正確的是 ( )
A.4.6g由NO2和N2O4組成的混合物中氧原子總數為0.2NA
B.標準狀況下,22.4L的SO3中含3NA個氧原子。
C.100mL18.4mol/L的濃硫酸與足量的銅加熱反應,轉移的電子數為1.84NA
D.密閉的容器中,催化劑作用下0.5molN2與1.5molH2反應后得到NH3分子數一定為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼及其化合物在工業上有許多用途。工業上以鐵硼礦為原料制備硼酸,鐵硼礦含有Mg、Fe、Ca、Al、B、O等多種元素,它的主要成分為Mg2B2O5H2O和Fe3O4。
(1)基態鐵原子的外圍電子層排布為_____________,該元素位于元素周期表中的第_____________族,在水溶液中常以Fe2+、Fe3+的形式存在,其中_____________更穩定。
(2)以硼酸為原料可制得NaBH4,B原子的雜化方式為_____________。
(3)第ⅤA族元素的原子R與A原子結合形成RA3氣態分子,其立體結構呈三角錐形。RCl5在氣態和液態時,分子結構如圖所示,下列關于RCl5分子的說法中不正確的是( )

A.分子中5個R﹣Cl鍵鍵能不都相同
B.鍵角(Cl﹣R﹣Cl)有90°、120、180°幾種
C.RCl5受熱后會分解生成分子立體結構呈三角錐形的RCl3
D.每個原子都達到8電子穩定結構
(4)因為氯化鋁易升華,其雙聚物Al2Cl6結構如圖1所示。1mol該分子中含__________個配位鍵,該分子________(填“是”或“否”)平面型分子。

(5)純疊氮酸(HN3)在常溫下是一種液體,沸點較高,為308.8 K,主要原因是_________。
(6)二硫化碳屬于_________(填“極性”或“非極性”)分子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1mol分子式為CmHn的有機化合物在氧氣中完全燃燒,且生成CO2和H2O的物質的量相等,并消耗168L氧氣。(體積均在標準狀況下測定);
(1)該有機化合物的分子式。
(2)若分子中只有兩個甲基且屬于不飽和烴,寫出其結構簡式。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A可發生如下轉化(方框內物質均為有機物,部分無機產物已略去):

已知: (R、R'可表示烴基或官能團)
(R、R'可表示烴基或官能團)
請回答:
(1)F蒸氣密度是相同條件下H2密度的31倍,且分子中無甲基。已知1 mol F與足量鈉作用產生H2 22.4 L(標準狀況),則F的分子式是__________________。
(2)G與F的相對分子質量之差為4,則G的性質是________(填字母)。
a.可與銀氨溶液反應 b.可與乙酸發生酯化反應
c.可與氫氣發生加成反應 d.1 mol G可與2 mol新制Cu(OH)2發生反應
(3)D能與NaHCO3反應,且兩分子D可以反應得到含有六元環的酯類化合物,E可使溴的四氯化碳溶液褪色,則D→E的化學方程式是_______________________
(4)B的同分異構體較多,寫出一種不含甲基能發生銀鏡反應的同分異構體結構簡式:_________。
(5)A轉化為B和F的化學方程式是_________________________。
(6)某烴分子H的碳原子數小于10,核磁共振氫譜只有一組峰, 在相同條件下也可發生類似B → C的反應并只生成一種有機物I,I的結構簡式: _______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氯化亞鐵的熔點674℃、沸點1023℃;三氯化鐵在300℃以上易升華,易溶于水并且有強烈的吸水性。在500℃條件下氯化亞鐵與氧氣可能發生多種反應,反應之一為:12FeCl2 +3O2![]() 2Fe2O3 +8FeCl3。某研究小組選用以下裝置(夾持裝置省略,裝置可重復選用)進行反應的探究。回答下列問題:
2Fe2O3 +8FeCl3。某研究小組選用以下裝置(夾持裝置省略,裝置可重復選用)進行反應的探究。回答下列問題:


(1)裝置的合理連接順序為A、 、D,其中E裝置U形管左邊設計為粗導管的目的是 。
(2)A裝置中發生反應的化學方程式為 。
(3)反應過程發現,裝置B中除生成紅棕色固體外,還觀察到黃綠色氣體,生成該氣體的化學方程式為 。
(4)待B中充分反應后,停止加熱后,還需持續通氧氣至 。
(5)設計實驗:
①利用E裝置U形管里的固體驗證Fe(OH)3是弱堿: 。
②測定裝置B的殘留固體中鐵元素的質量分數: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加羅常數的值,下列有關敘述正確的個數為
①1mol苯乙烯中含有的碳碳雙鍵數為4NA
②4.2g乙烯和丙烯混合氣中含有的極性鍵數目為0.6NA
③標況下,3.36LHF含有的電子數為1.5NA
④常溫下1L 0.5mol/L NH4Cl溶液與2L 0.25mol/L NH4Cl溶液所含NH4+的數目相同
⑤常溫下4.6gNO2和N2O4混合氣體中所含原子總數為0.3NA
⑥在KClO3+6HCl(濃)=KCl+3Cl2+3H2O反應中,每生成1mol Cl2轉移的電子總數為2 NA
⑦1mol鐵粉在1mol氯氣中充分燃燒,失去的電子數為3NA
⑧高溫下,16.8g Fe與足量水蒸氣完全反應失去0.8NA個電子.
A.3個 B.4個 C.5個 D.6個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鋅錳干電池是一種一次電池,外殼為金屬鋅,中間是碳棒,其周圍有碳粉,二氧化錳,氯化鋅和氯化銨等組成的填充物,該電池在放電過程產生MnOOH(難溶于水),回收處理該廢電池可以得到多種化工原料,有關數據下圖所示:
溶解度/(g/100g水)
溫度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列問題:
①普通鋅錳電池放電時發生的主要反應為:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。該電池中,負極材料主要是________,正極發生的主要反應式是 。
加堿調節溶液pH,使溶液中氫氧根離子濃度達到 mol/L,鐵剛好完全沉淀(離子濃度小于1×10-5mol/L時,即可認為該離子沉淀完全)。繼續加堿調節pH為 ,鋅開始沉淀(假定Zn2+濃度為0.1mol/L)。
(2)在分析化學中常用Na2C2O4晶體(溶液無色)作為基準物質測定KMnO4溶液的濃度。在H2SO4溶液中,反應如下:2MnO+5C2O+16H+![]() 2Mn2+(溶液無色)+10CO2↑+8H2O。
2Mn2+(溶液無色)+10CO2↑+8H2O。
①若將W g Na2C2O4配成100 mL標準溶液,移取20.00 mL置于錐形瓶中,則酸性KMnO4溶液應裝在__________(填“酸式”或“堿式”)滴定管中。本次滴定 選擇指示劑(填“需要”、“不需要”)。判斷滴定達終點的現象是____ ___。
②若滴定管起始讀數和終點讀數如圖所示,則酸性KMnO4的物質的量濃度為_ (填表達式)。
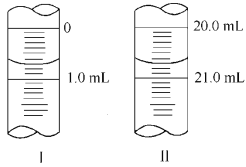
③若滴定完畢立即讀數,測定的KMnO4溶液的濃度___(填“偏高”、“偏低”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com