

分析 工業碳酸鈣(含有少量Na+、Al3+、Fe3+等雜質),加入鹽酸可完全溶解生成氯化鈣、氯化鐵以及氯化鈉、氯化鋁等,加入氫氧化鈣溶液,以除去溶液中少量的Fe3+,然后在酸性條件下蒸發結晶可得到CaCl2•2H2O,
(1)Fe3+與KSCN反應生成紅色物質Fe(SCN)3,檢驗Fe3+是否存在的,選用KSCN溶液;
(2)因在除雜過程中加入了Ca(OH)2,故加入鹽酸與溶液中的少量Ca(OH)2反應使其轉化為CaCl2;另Ca(OH)2易吸收空氣中的CO2,生成CaCO3沉淀,故加入鹽酸還可以防止溶液吸收空氣中CO2,Ca(OH)2吸收空氣中的CO2,生成CaCO3沉淀,如果吸收大量的CO2 會導致最終質量分數偏低;
(3)①根據到達滴定終點生成氯化銀的物質的量等于消耗的硝酸銀的物質的量這一關系求出消耗硝酸銀的物質的量,則n(AgCl)=2n(CaCl2.2H2O),
據此可以算出實際上的CaCl2.2H2O的物質的量,進而求出質量.注意的是我們是從250mol中取25ml,所以在計算時要注意這一點;
②樣品中存在少量的NaCl,根據 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物質的量增大.同樣若CaCl2.2H2O失水導致分母變小,值偏大.
解答 解:工業碳酸鈣(含有少量Na+、Al3+、Fe3+等雜質),加入鹽酸可完全溶解生成氯化鈣、氯化鐵以及氯化鈉、氯化鋁等,加入氫氧化鈣溶液,以除去溶液中少量的Fe3+,然后在酸性條件下蒸發結晶可得到CaCl2•2H2O,
(1)Fe3+與KSCN反應生成紅色物質Fe(SCN)3,檢驗Fe3+是否存在的,選用KSCN溶液,
故答案為:取少量上層清液,滴加KSCN溶液,若不出現血紅色,則表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入鹽酸,調節溶液的pH約為4.0,其目的有:①將溶液中的少量Ca(OH)2轉化為CaCl2; ②防止Ca2+在蒸發時水解;③防止溶液吸收空氣中CO2,
故答案為:將溶液中的少量Ca(OH)2轉化為CaCl2;防止Ca2+在蒸發時水解;防止溶液吸收空氣中CO2;
(3)①樣品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根據n(AgCl)=2n(CaCl2.2H2O),則n(CaCl2.2H2O)=0.0050975mol,所以m(CaCl2.2H2O)=0.0050975mol×147g/mol=0.7493325g,則有:$\frac{0.7493225g}{0.7500g}$×100%=99.9%,
故答案為:99.9%;
②樣品中存在少量的NaCl會導致CaCl2.2H2O的物質的量增大.同樣若CaCl2.2H2O失水導致分母變小,值偏大,
故答案為:樣品中存在少量的NaCl或少量的CaCl2.2H2O失水.
點評 本題考查混合物中含量的測定,涉及實驗的基本操作、實驗儀器的選擇、實驗誤差分析、混合物分離及含量測定的計算等,注意離子的檢驗方法和常見儀器的使用,樣品純度的分析要注意溶液中可能發生的反應,注意有效數字問題,題目綜合性較強,難度中等.


 課課練江蘇系列答案
課課練江蘇系列答案 名牌中學課時作業系列答案
名牌中學課時作業系列答案 明天教育課時特訓系列答案
明天教育課時特訓系列答案 浙江新課程三維目標測評課時特訓系列答案
浙江新課程三維目標測評課時特訓系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②⑤ | C. | ③⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
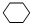 ,名稱是環己烷,該烴的二氯代物有4種.
,名稱是環己烷,該烴的二氯代物有4種.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| D. | 水電離出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com