
【題目】下列物質的水溶液因水解呈酸性的是( )
A.KCl
B.NaHSO4
C.NaHCO3
D.AlCl3
科目:高中化學 來源: 題型:
【題目】合成氨是化學科學對人類社會發展與進步作出巨大貢獻的典例之一,合成氨工業包括原料氣的制備、凈化、氨的合成及各種化肥生產等.
(1)醋酸二胺合銅(I)可以除去原料氣中的CO.Cu+基態核外電子排布式為 , 生成的CH3COO[Cu(NH3)3CO]中與Cu+形成配離子的配體為(填化學式).
(2)NH4NO3中N原子雜化軌道類型為 , 與NO3﹣互為等電子體的分子為(填化學式,舉一例).
(3)1mol CO(NH2)2H2O2(過氧化尿素)中含有σ鍵的數目為 .
(4)釘(Ru)系催化劑是目前合成氨最先進的催化劑,一種釕的化合物晶胞結構如圖所示,有關該晶體的說法正確的是(填字母).
a.晶胞中存在“RuO62﹣”正八面體結構
b.與每個Ba2+緊鄰的O2﹣有12個
c.與每個O2﹣緊鄰的Ru4+有6個
d.晶體的化學式為BaRuO3 . 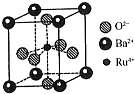
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )。
A. NaCl的摩爾質量是58.5g/mol B. 1mol NaOH的質量是40g
C. 1mol氮的質量是14g D. 1mol水的質量是18g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A. 物質的量濃度為0.5 mol/L的MgCl2溶液中,含有Cl-的數目為 NA
B. 11.2 g Fe與足量水蒸氣反應,生成的H2分子數目為0.3 NA
C. 標準狀況下,22.4LH2O含有的分子數為NA
D. 2.3 g Na與一定量氧氣反應生成Na2O和Na2O2的混合物,轉移的電子數一定為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制取乙酸乙酯,如圖1所示實驗裝置: 
請回答下列問題:
(1)能完成本實驗的裝置是(從甲、乙、丙中選填)
(2)試管B中裝入的液體為 . 試管B中發生反應的化學方程式為 .
(3)制取乙酸乙酯時加入試劑順序為 , 發生反應的化學方程式為 .
(4)從制備乙酸乙酯所得的混合物中分離、提純乙酸乙酯時,需要經過多步操作,下列圖2示的操作中,肯定需要的化學操作是(選填答案編號).
(5)有機物的分離操作中,經常需要使用分液漏斗等儀器.使用分液漏斗前必須;某同學在進行分液操作時,若發現液體流不下來,應采取的措施是
(6)用30g乙酸和40g乙醇反應,可以得到37.4g乙酸乙酯,則該實驗的產率(產率指的是某種生成物的實際產量與理論產量的比值)是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A(g)+B(g)C(g)+D(g)發生過程中的能量變化如圖所示,下列說法不正確的是( ) 
A.該反應的△H<0
B.反應體系中加入催化劑,E1減小,E2增大
C.反應體系中加入催化劑,△H不變
D.反應達到平衡時,升高溫度,A的轉化率減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列問題:
(1)該反應的化學平衡常數表達式為K= .
(2)從表中看出,升高溫度,K值 , 則CO2的轉化率 , 化學反應速率 . (以上均填“增大”“減小”或“不變”)
(3)能判斷該反應是否達到化學平衡狀態的依據是
A.容器中壓強不變
B.混合氣體中c(CO)不變
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)c(H2)=c(CO)c(H2O),試判斷此時的溫度為℃.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】400 mL某濃度的NaOH溶液與5.6 L Cl2(標準狀況)恰好完全反應,計算(寫出必要的計算過程):
(1)生成的NaClO的物質的量。_____________
(2)該溶液中NaOH的物質的量濃度。__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生欲通過實驗方法驗證Fe2+的性質.
(1)該同學在實驗前,依據Fe2+的性,填寫了下表.
實驗操作 | 預期現象 | 反應的離子方程式 |
向盛有新制FeSO4溶液的試管中滴入數滴濃硝酸,振蕩 | 試管中產生紅棕色氣體,溶液顏色逐漸變黃 | Fe2++NO |
依照表中操作,該同學進行實驗.觀察到液面上方氣體逐漸變為紅棕色,但試管中溶液顏色卻變為深棕色.
(2)為了進一步探究溶液變成深棕色的原因,該同學進行如下實驗.向原新制FeSO4溶液和反應后溶液中均加入KSCN溶液,前者不變紅色,后者(加了數滴濃硝酸的FeSO4溶液)變紅.該現象的結論是 .
(3)該同學通過查閱資料,認為溶液的深棕色可能是NO2或NO與溶液中Fe2+或Fe3+發生反應而得到的.為此他利用如圖裝置(氣密性已檢驗,尾氣處理裝置略)進行探究.ⅰ.打開活塞a、關閉b,并使甲裝置中反應開始后,觀察到丙中溶液逐漸變為深棕色,而丁中溶液無明顯變化.
ⅱ.打開活塞b、關閉a,一段時間后再停止甲中反應.
ⅲ.為與ⅰ中實驗進行對照,更換丙、丁后(溶質不變),使甲中反應繼續,觀察到的現象與步驟ⅰ中相同.
①銅與足量濃硝酸反應的化學方程式是;
②裝置乙的作用是;
③步驟ⅱ的目的是;
④該實驗可得出的結論是 .
(4)該同學重新進行(1)中實驗,觀察到了預期現象,其實驗操作是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com