
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
分析 (1)達到平衡后,體積不變時,能提高H2O的平衡轉化率,應使平衡向正反應方向移動,反應是氣體體積不變的吸熱反應;
(2)依據熱化學方程式和蓋斯定律計算分析得到;
(3)①正反應放熱,降溫時平衡正向移動;
②平衡常數表達式為K=$\frac{生成物平衡濃度的冪次方乘積}{反應物平衡濃度的冪次方乘積}$;
③反應前后氣體體積不變,等比例加入反應物,平衡與原平衡等效.
解答 解:(1)達到平衡后,體積不變時,能提高H2O的平衡轉化率,應使平衡向正反應方向移動,反應是氣體體積不變的吸熱反應;
A.反應是吸熱反應,升高溫度平衡正向進行,反應速率增大,有利于提高H2O的平衡轉化率,故A符合;
B.增加碳的用量,固體不改變化學平衡,水的轉化率不變,故B不符合;
C.加入催化劑改變化學反應速率,不改變化學平衡,水的轉化率不變,故C不符合;
D.用CO吸收劑除去CO,平衡正向進行,水的轉化率增大,故D符合;
故答案為:AD;
(2)①C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,
②C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,
依據熱化學方程式和蓋斯定律②-①得到,CO(g)+H2O(g)?CO2(g)+H2(g),△H=-41.2kJ•mol-1;
故答案為:-41.2kJ•mol-1 ;
(3)①正反應放熱,降溫時平衡正向移動,v(正)>v(逆),
故答案為:<;
②CO和H2O反應了0.06mol,則CO2和H2生成了0.06mol,平衡時各物質的濃度為:反應物CO和H2O為0.05mol/L,生成物CO2和H2為0.03mol/L,平衡常數表達式為K=$\frac{生成物平衡濃度的冪次方乘積}{反應物平衡濃度的冪次方乘積}$=$\frac{0.03mol/L×0.03mol/L}{0.05mol/L×0.05mol/L}$=0.36,
故答案為:0.36;
③反應前后氣體體積不變,與原平衡等比例加入反應物,平衡與原平衡等效,所以,平衡時各物質的濃度與原判斷相同,
故答案為:不變.
點評 本題主要考查了平衡移動、蓋斯定律應用、平衡常數的計算、等效平衡,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 氮原子的質量就是氮的相對原子質量 | |
| B. | 氫氧化鈉的摩爾質量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氬氣的摩爾質量在數值上等于它的相對原子質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 以NaCl等為原料制備KClO4的過程如下:
以NaCl等為原料制備KClO4的過程如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,含有離子鍵和非極性共價鍵的化合物的電子式為
,含有離子鍵和非極性共價鍵的化合物的電子式為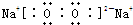 ;含有極性共價鍵和非極性共價鍵的化合物的電子式為
;含有極性共價鍵和非極性共價鍵的化合物的電子式為 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 氫氣、甲醇是優質的清潔燃料,可制作燃料電池.
氫氣、甲醇是優質的清潔燃料,可制作燃料電池.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
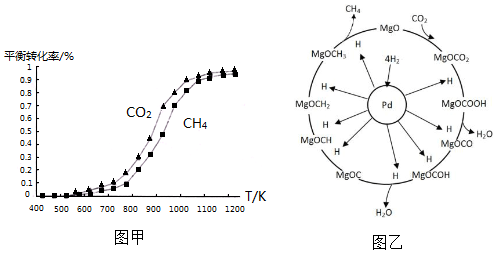 ①同溫度下CO2的平衡轉化率大于(填“大于”或“小于”)CH4的平衡轉化率,其原因是CO2發生了其他副反應.
①同溫度下CO2的平衡轉化率大于(填“大于”或“小于”)CH4的平衡轉化率,其原因是CO2發生了其他副反應. CH4+2H2O.
CH4+2H2O.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com