
分析 (1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl,反應中氫元素化合價升高失電子做還原劑,氯元素化合價降低得到電子做氧化劑,電子轉移總數2e-;
(2)在反應Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合價由0升高到+2價,則Zn為還原劑,H元素的化合價由+1降低到0價,則H2SO4為氧化劑;
(3)2KMnO4═K2MnO4+MnO2+O2↑中Mn的化合價降低,O的化合價升高,轉移電子是4mol,氧化還原反應中元素化合價升高的物質失電子最還原劑,元素化合價降低得到電子做氧化劑.
解答 解:(1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl,反應中氫元素化合價0價變化為+1價,氫氣做還原劑,氯元素化合價0價變化為-1價,氯氣做氧化劑,電子轉移總數2e-,電子轉移的方向和數目為: ,故答案為:
,故答案為: ;Cl2;H2;
;Cl2;H2;
(2)在反應Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合價由0升高到+2價,則Zn為還原劑,H元素的化合價由+1降低到0價,則H2SO4為氧化劑,
該反應中轉移的電子數為2e-,電子轉移的方向和數目為 ,故答案為:
,故答案為: ;H2SO4;Zn;
;H2SO4;Zn;
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中Mn的化合價降低,O的化合價升高,所以KMnO4是氧化劑,KMnO4是還原劑,K2MnO4、MnO2是還原產物,O2是氧化產物,轉移電子是4mol,電子轉移情況如下: ;KMnO4是氧化劑,KMnO4是還原劑,
;KMnO4是氧化劑,KMnO4是還原劑,
故答案為: ;KMnO4;KMnO4.
;KMnO4;KMnO4.
點評 本題考查氧化還原反應,為高頻考點,側重于基本概念、電子轉移表示方法的考查,難度不大,注意對基礎知識的理解掌握.


 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | BF3是三角錐形分子 | |
| B. | NH4+的電子式: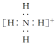 ,離子呈平面形結構 ,離子呈平面形結構 | |
| C. | CO2的分子模型示意圖: | |
| D. | CH4分子中的碳原子以4個sp3雜化軌道分別與4個氫原子的1s軌道重疊,形成4個s-sp3σ鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
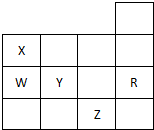
| A. | 常溫時五種元素的單質中,Z單質的沸點最高 | |
| B. | Y元素的非金屬性比W元素的非金屬性強 | |
| C. | Y、Z的陰離子的電子層結構都與R原子的相同 | |
| D. | Y的氫化物的沸點比H2O的沸點高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水玻璃-混合物氨水-弱堿 | |
| B. | 油脂-天然高分子化合物 有機玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半導體材料硅單質-光纖材料 | |
| D. | 高錳酸鉀溶液-氧化性碳酸鈉溶液-堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向稀鹽酸中加NaNO3溶液 | B. | 向稀鹽酸中加碳酸鈉固體 | ||
| C. | 將鋅粒制成薄片 | D. | 向稀鹽酸中加食鹽水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 手機上用的鋰離子電池屬于一次電池 | |
| B. | 人們回收廢舊電池主要是為了防止重金屬對水土的污染 | |
| C. | 氫氧燃料電池的能量轉化率可達100% | |
| D. | 太陽能電池的主要材料為二氧化硅 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 實驗室制備1,2一二溴乙烷的反應原理如下:
實驗室制備1,2一二溴乙烷的反應原理如下:| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com