


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 選項 | ① | ② | ③ | 實驗結論 | 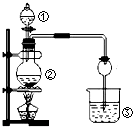 |
| A | 濃鹽酸 | MnO2 | NaBr | 氧化性Cl2>Br2 | |
| B | 濃氨水 | 堿石灰 | AgNO3溶液 | AgOH具有兩性 | |
| C | 濃硫酸 | Na2SO4 | FeCl3溶液 | SO2具有還原性 | |
| D | 稀鹽酸 | Na2CO3 | Na2SiO3 | 非金屬性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、2mol水的摩爾質量是36g?mol-1 | ||
B、一個鈉原子的實際質量約等于
| ||
| C、1.5mol O2的體積約為33.6L | ||
| D、將 100mL水加入到 100mL 1mol/L的NaOH溶液中,所得溶液為0.5mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
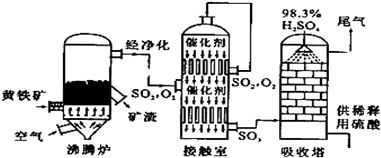
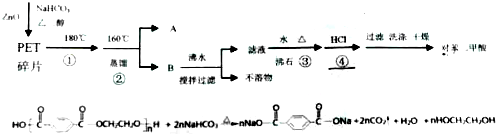
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、NaOH+HCl=NaCl+H2O | ||||
| B、Fe+2HCl=FeCl2+H2↑ | ||||
| C、CuO+2HCl=CuCl2+H2 O | ||||
D、MnO2+4HCl(濃)
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com