

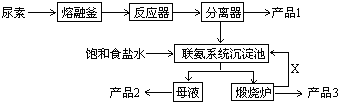
分析 根據聯合制堿法的原料為氨氣、二氧化碳和飽和氯化鈉,反應式為NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;主要的副產物為氯化銨,需要考慮氯化銨的回收利用,要提高原料的利用率,可以用循環使用的方法,
(1)工業制純堿法為侯氏制堿或聯合制堿法,主要副產品為NH4Cl;
(2)飽和食鹽水中通入氨氣和二氧化碳析出碳酸氫鈉晶體;
(3)碳酸氫鈉受熱易分解生成CO2、水及純堿;
(4)循環Ⅰ中的氯化鈉有又返回到沉淀池;從固液混合物中分離出固體的方法為過濾;
(5)粗鹽樣品含有Ca2+、Mg2+、SO42-,除去鈣離子用碳酸鈉,除去鎂離子用氫氧根離子,除去硫酸根離子用鋇離子,由于加入的試劑均過量,則加入碳酸鈉溶液應該放在氯化鋇溶液之后即可;
(6)檢驗產品碳酸鈉中是否含有氯化鈉即檢驗是否含氯離子,用硝酸酸化的硝酸銀即可;
(7)根據氨氣溶于水后生成氨水,氨水電離成銨根,增大銨根的濃度有利于氯化銨的析出來分析;同時通入氨氣使溶液堿性增強,使碳酸氫鈉轉換為溶解度較大的碳酸鈉,可以提高氯化銨的純度.
解答 解:(1)題中方法由我們侯德邦所創,稱為侯氏制堿法,也稱為聯合制堿法,反應方程式為NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,得到一摩爾的碳酸氫鈉同時得到一摩爾的氯化銨,故副產物為氯化銨,氯化銨可用來制作化肥,
故答案為:聯合制堿法;做化肥;
(2)沉淀池中發生的化學反應為飽和食鹽水中通入氨氣和二氧化碳析出碳酸氫鈉晶體,反應方程式為NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案為:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
(3)煅燒爐中為加熱碳酸氫鈉分解生成碳酸鈉、水和二氧化碳,在聯合制堿法中二氧化碳是反應的原料同時也是反應的副產物,可以循環利用,所以X物質的分子式為CO2;故答案為:CO2;
(4)循環Ⅰ是將未反應的氯化鈉返回沉淀池中,從固液混合物中分離出固體的方法為過濾;
故答案為:循環Ⅰ,過濾;
(5)粗鹽樣品含有Ca2+、Mg2+、SO42-,除去Ca2+用過量的Na2CO3溶液,除去Mg2+用氫氧根離子,除去SO42-用鋇離子,由于加入的試劑均過量,則加入Na2CO3溶液應該放在氯化鋇溶液之后,所以a錯誤,bc正確;故選:bc;
(6)檢驗產品碳酸鈉中是否含有氯化鈉即檢驗是否含氯離子,可以取少量試樣溶于水后,用硝酸酸化的硝酸銀,觀察到若產生白色沉淀則說明有氯化鈉存在,故答案為:取少量試樣溶于水后,再滴加硝酸酸化的硝酸銀,觀察產生白色沉淀;
(7)氨氣溶于水后生成氨水,氨水電離成銨根,增大銨根的濃度有利于氯化銨的析出來,所以A正確;通入氨氣使溶液堿性增強,使碳酸氫鈉轉換為溶解度較大的碳酸鈉,可以提高氯化銨的純度所以C正確,B錯誤;
故答案為:AC.
點評 本題主要考察了聯合制堿法的原料、反應式以及副產物的回收利用,如何提高原料的利用率、檢驗氯離子的方法是關鍵.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若溫度不變將容器的容積增大1倍,達到新平衡時A的濃度變為原來的0.45 倍,則m+n>p+q | |
| B. | 若平衡時,A、B的轉化率相等,說明反應開始時,A、B的物質的量之比為m:n | |
| C. | 若升高平衡體系的溫度,達到新平衡時A 的濃度變為原來的0.55 倍,說明該反應△H<0 | |
| D. | 若平衡后同時增大A、B的濃度,則A、B的轉化率一定都減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
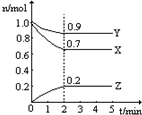 某溫度時,在一個2L恒容的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據,試填寫下列空白:
某溫度時,在一個2L恒容的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據,試填寫下列空白:| 編號 | 改變的條件 | 正反應的速率 |
| ① | 降低溫度 | |
| ② | 增大Y的濃度 | |
| ③ | 使用合適的催化劑 | |
| ④ | 增大容器體積 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
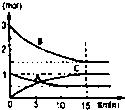 在某容積不變的密閉容器中,有可逆反應:mA(g)+nB(g)?pC(g)+qD(S)△H<0如圖某反應過程中各物質物質的量n(mol)隨時間t的變化曲線圖.
在某容積不變的密閉容器中,有可逆反應:mA(g)+nB(g)?pC(g)+qD(S)△H<0如圖某反應過程中各物質物質的量n(mol)隨時間t的變化曲線圖.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150 mL 1mol/L氯化鈉溶液 | B. | 5 mL 2mol/L 氯化銨溶液 | ||
| C. | 150 mL 1mol/L氯化鉀溶液 | D. | 75 mL 1.5mol/L 氯化鎂溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com