

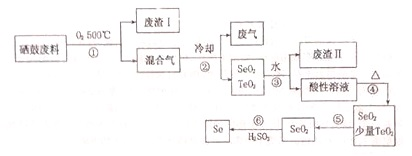
| 物理性質 | 熔點 | 沸點 | 升華 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
分析 Ⅰ、(1)裝置圖分析可知該裝置是原電池反應;
(2)H2失去電子,故H2的一極為負極;
(3)SO2在負極失去電子轉化為SO42-,故其電極反應為:SO2+2H2O-2e-=SO42-+4H+;
Ⅱ、硒鼓廢料(主要成分硒、碲、碳、銅和鐵合金)在空氣中燃燒生成二氧化碳、二氧化硒、二氧化碲、氧化銅等,500℃時SeO2與TeO2均為氣體,冷卻,加水SeO2溶解,酸性溶液主要是亞硒酸,廢渣II為TeO2,亞硒酸受熱分解生成二氧化硒,及少量TeO2,升華分離得純凈的二氧化硒,再加亞硫酸溶液還原得到Se單質;
(1)Se的最高正價為+6價,最高價氧化物對應水化物為酸;
(2)硒鼓廢料(主要成分硒、碲、碳、銅和鐵合金)在空氣中燃燒生成二氧化碳、二氧化硒、二氧化碲、氧化銅等,500℃時SeO2與TeO2均為氣體,冷卻得到SeO2與TeO2固體;
(3)SeO2與水反應生成亞硒酸,亞硒酸受熱分解;亞硫酸與二氧化硒反應生成硒和硫酸;
(4)根據SeO2易升華來分析.
解答 解:Ⅰ、(1)裝置圖分析可知該裝置是原電池反應,是化學能轉化為電能的裝置,故答案為:原電池;
(2)H2失去電子,故H2的一極為負極,故答案為:負;
(3)SO2在負極失去電子轉化為SO42-,故其電極反應為:SO2+2H2O-2e-=SO42-+4H+,故答案為:SO2+2H2O-2e-=SO42-+4H+;
Ⅱ、硒鼓廢料(主要成分硒、碲、碳、銅和鐵合金)在空氣中燃燒生成二Ⅱ、氧化碳、二氧化硒、二氧化碲、氧化銅等,500℃時SeO2與TeO2均為氣體,冷卻,加水SeO2溶解,酸性溶液主要是亞硒酸,廢渣II為TeO2,亞硒酸受熱分解生成二氧化硒,及少量TeO2,升華分離得純凈的二氧化硒,再加亞硫酸溶液還原得到Se單質;
(1)Se的最高正價為+6價,最高價氧化物對應水化物為酸,化學式為H2SeO4,故答案為:H2SeO4;
(2)硒鼓廢料(主要成分硒、碲、碳、銅和鐵合金)在空氣中燃燒生成二氧化碳、二氧化硒、二氧化碲、氧化銅等,500℃時SeO2與TeO2均為氣體,冷卻得到SeO2與TeO2固體,廢氣為二氧化碳,故答案為:CO2;
(3)硒鼓廢料(主要成分硒、碲、碳、銅和鐵合金)在空氣中燃燒生成二氧化碳、二氧化硒、二氧化碲、氧化銅等,500℃時SeO2與TeO2均為氣體,冷卻,加水SeO2溶解,酸性溶液主要是亞硒酸,廢渣II為TeO2,亞硒酸受熱分解生成二氧化硒,反應④的化學方程式為:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O,升華分離得純凈的二氧化硒,再加亞硫酸溶液還原得到Se單質,反應⑥的化學方程式為:2H2SO3+SeO2=Se+2H2SO4;
故答案為:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;2H2SO3+SeO2=Se+2H2SO4;
(4)由表格中數據可知,SeO2在315℃以上易升華,TiO2在450℃以上升華,所以控制溫度在315℃到450℃之間,使SeO2升華分離;
故答案為:升華,將溫度控制在315℃到450℃之間.
點評 本題考查了工藝流程圖,主要考查了物質的分離、提純等實驗操作,及有關的化學反應,題目難度中等,注意把握重要非金屬元素單質及其化合物的性質.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 苯與濃硝酸、濃硫酸共熱并保持50~60℃反應生成硝基苯 | |
| B. | 苯乙烯在合適條件下催化加氫可生成乙基環己烷 | |
| C. | 乙烯與溴的四氯化碳溶液反應生成1,2-二溴乙烷 | |
| D. | 用乙醇和3%的硫酸共熱到170℃制取乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯與溴水(加成反應) | B. | 苯與液溴(取代反應) | ||
| C. | 乙醇與乙酸的酯化反應(取代反應) | D. | 乙醇與氧氣(取代反應) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 1 | 2 | 3 | |
| 空白實驗消耗硫酸鈰標準溶液的體積(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克樣品消耗硫酸鈰標準溶液的體積(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
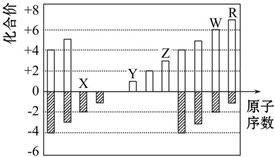
| A. | 原子半徑:Z>Y>X | |
| B. | 氣態氫化物的穩定性:R<W | |
| C. | WX2和水反應形成的化合物是一種強酸 | |
| D. | Y和Z兩者最高價氧化物對應的水化物能相互反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J |
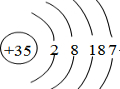 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com