
| A. | 將pH=a的醋酸稀釋變為pH=a+1,醋酸的濃度則變為原來的$\frac{1}{10}$ | |
| B. | 將pH=a的醋酸稀釋為pH=a+1的過程中,c(CH3COOH)/c(H+)$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$變小 | |
| C. | pH=a的醋酸與pH=a+1的醋酸分別中和等物質的量的NaOH溶液,二者所消耗體積比為1:10 | |
| D. | 等體積pH=a的醋酸與pH=b的NaOH溶液恰好中和時,存在a+b=14 |
分析 A.醋酸為弱酸,加水稀釋促進電離;將pH=a的醋酸稀釋變為pH=a+1,體積應小于原來的10倍;
B.將pH=a的醋酸稀釋為pH=a+1的過程中,醋酸電離程度增大,結合醋酸、氫離子的物質的量判斷;
C.醋酸濃度越大,電離程度越小;
D.pH=a的醋酸與pH=b的NaOH溶液恰好中和,醋酸和氫氧化鈉的物質的量相等.
解答 解:A.如醋酸為強酸,則將pH=a的醋酸稀釋變為pH=a+1,醋酸的濃度則變為原來的$\frac{1}{10}$,但醋酸為弱酸,加水稀釋促進電離,將pH=a的醋酸稀釋變為pH=a+1,體積應小于原來的10倍,則醋酸的濃度大于原來的$\frac{1}{10}$,故A錯誤;
B.將pH=a的醋酸稀釋為pH=a+1的過程中,醋酸電離程度增大,n(CH3COOH)減小,n(H+)增大,則$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$減小,故B正確;
C.醋酸濃度越大,電離程度越小,則pH=a的醋酸電子程度較小,pH=a的醋酸與pH=a+1的醋酸分別中和等物質的量的NaOH溶液,二者所消耗體積比大于1:10,故C錯誤;
D.pH=a的醋酸與pH=b的NaOH溶液恰好中和,醋酸和氫氧化鈉的物質的量相等,如醋酸為強酸時存在a+b=14,但醋酸為弱酸,故D錯誤.
故選B.
點評 本題考查弱電解質的電離,側重于學生的分析能力的考查,為高考常見題型,注意把握弱電解質的電離特點以及影響因素,難度不大.


 名師金手指領銜課時系列答案
名師金手指領銜課時系列答案科目:高中化學 來源: 題型:解答題
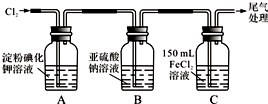
| 實 驗 步 驟 | 預期現象和結論 |
| 步驟1:取適量B瓶中溶液于一干凈試管中,滴加過量稀鹽酸和適量的BaCl2溶液,振蕩. | 若產生白色沉淀,則B瓶溶液中存在SO42-. |
步驟2:另取適量B瓶中溶液于試管一干凈試管中,滴加過量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振蕩,靜置. | 產生白色沉淀. |
| 步驟3:取步驟2后試管中的上層清液于一干凈試管中,滴加01mol/L AgNO3溶液,振蕩. | 若產生白色沉淀,則B瓶溶液中存在Cl-. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 15g甲基所含有的電子數是10NA個 | |
| B. | 1mol苯乙烯中含有的碳、碳雙鍵數為4NA個 | |
| C. | 標準狀況下,1L庚烷所含有的分子數為NA/22.4 | |
| D. | 常溫下,14g乙烯和丙烯的混合物中總原子數為3NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
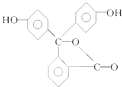
| A. | 酚酞與水可以形成氫鍵 | |
| B. | 酚酞的分子式為C20H14O4 | |
| C. | 酚酞結構中含有羥基(-OH),故酚酞屬于醇 | |
| D. | 酚酞在一定條件下能夠發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所含共用電子對數目為$\frac{a}{7+1}$NA | B. | 所含碳氫鍵數目為$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃燒時消耗的O2一定是$\frac{33.6a}{14}$ L | D. | 所含原子總數為$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在金屬元素與非金屬元素的分界線附近可以尋找制備半導體材料的元素 | |
| B. | 在過渡元素中可以尋找制備催化劑及耐高溫材料的元素 | |
| C. | 在金屬元素區域中可以尋找制備新型農藥材料的元素 | |
| D. | 23592U可用作核反應堆的燃料,21H與31H可用作制造氫彈的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 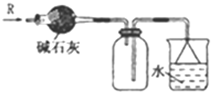 可用于SO2氣體的干燥,收集并吸收多余SO2氣體,防止SO2逸出污染空氣并防止倒吸 可用于SO2氣體的干燥,收集并吸收多余SO2氣體,防止SO2逸出污染空氣并防止倒吸 | |
| B. | 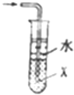 當X選用苯時可進行NH3和HCl的吸收,并防止倒吸 當X選用苯時可進行NH3和HCl的吸收,并防止倒吸 | |
| C. |  進行H2,NH3,CO2,Cl,HCl,NO2等氣體收集,但不能用于NO氣體收集 進行H2,NH3,CO2,Cl,HCl,NO2等氣體收集,但不能用于NO氣體收集 | |
| D. | 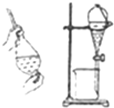 利用氯仿(CHCl3)密度大于乙醇,進行氯仿與乙醇混合物的分離 利用氯仿(CHCl3)密度大于乙醇,進行氯仿與乙醇混合物的分離 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com