
太陽能電池是通過光電效應或者光化學效應直接把光能轉化成電能的裝置。其材料有單晶硅,還有銅、鍺、鎵、硒等化合物。
(1)基態亞銅離子中電子占據的原子軌道數目為____________。
(2)若基態硒原子價層電子排布式寫成4s24px24py4,則其違背了____________。
(3)左下圖表示碳、硅和磷元素的四級電離能變化趨勢,其中表示磷的曲線是____________(填標號)。
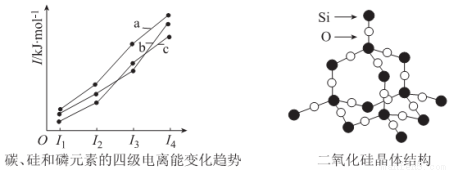
(4)單晶硅可由二氧化硅制得,二氧化硅晶體結構如右上圖所示,在二氧化硅晶體中,Si、O
原子所連接的最小環為____________元環,則每個O原子連接____________個最小環。
(5)與鎵元素處于同一主族的硼元素具有缺電子性。自然界中含硼元素的鈉鹽是一種天然礦藏,其化學式寫作Na2B4O7·10H2O,實際上它的結構單元是由兩個H3BO3和兩個[B(OH)4]-縮合而成的雙六元環,應該寫成Na2[B4O5(OH)4]8H2O.其結構如圖所示,它的陰離子可形成鏈狀結構。
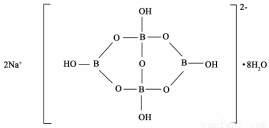
①該晶體中不存在的作用力是____________(填選項字母)。
A.離子鍵B.共價鍵C.金屬鍵D.范德華力E.氫鍵
②陰離子通過____________相互結合形成鏈狀結構。
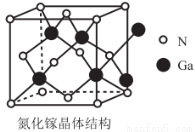
(6)氮化嫁(GaN)的晶體結構如圖所示。晶體中N、Ga原子的軌道雜化類型是否相同____________(填“是”或“否”),判斷該晶體結構中存在配位鍵的依據是____________。

(7)某光電材料由鍺的氧化物與銅的氧化物按一定比例熔合而成,其中鍺的氧化物晶胞結構如下圖所示,該物質的化學式為____________。已知該晶體密度為7.4g/cm3,晶胞邊長為4.3×10-10m。則鍺的相對原子質量為____________(保留小數點后一位)。
科目:高中化學 來源:2016屆湖北省沙市高三高考前最后一卷理綜化學試卷(解析版) 題型:選擇題
用NaOH溶液吸收煙氣中的SO2,將所得的Na2SO3溶液進行電解,可循環再生NaOH,同時得到H2SO4,其原理如圖所示(電極材料為石墨)。下列有關敘述不正確的是
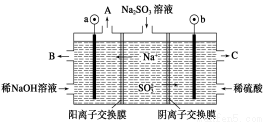
A.圖中a極連接電源的負極
B.A口放出的物質是氫氣,C口放出的物質是氧氣
C.b極電極反應式為:SO32--2e-+H2O===SO42-+2H+
D.電解過程中陰極區堿性明顯增強
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省等三校高三第四次模擬化學試卷(解析版) 題型:選擇題
下列有關物質的性質或應用均正確的是
A.二氧化硅為酸性氧化物,可用于制做計算機芯片
B.銅的金屬活潑性比鐵差,可在海輪外殼上裝若干銅塊以減緩其腐蝕
C.Zn具有還原性和導電性,可用作鋅錳干電池的負極材料
D.濃硫酸具有脫水性,可用于干燥NH3、SO2等
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月模擬三理綜化學試卷(解析版) 題型:填空題
鈦、鉻、鐵、鎳、銅等金屬及其化合物在工業上有重要用途。
(1)鈦鐵合金是鈦系儲氫合金的代表,該合金具有放氫溫度低、價格適中等優點。
①Ti的基態原子價電子排布式為________________。
②Fe的基態原子共有________種不同能級的電子。
(2)制備CrO2Cl2的反應為K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化學方程式中非金屬元素電負性由大到小的順序是__________(用元素符號表示)。
②COCl2分子中所有原子均滿足8電子構型,COCl2分子中σ鍵和π鍵的個數比為_____,中心原子的雜化方式為________。
(3)NiO、FeO的晶體結構均與氯化鈉的晶體結構相同,其中Ni2+和Fe2+的離子半徑分別為690pm和780pm。則熔點:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用廣泛的儲氫材料,具有大容量、高壽命、耐低溫等特點,在日本和中國已實現了產業化。該合金的晶胞結構如圖所示。
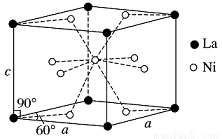
①該晶體的化學式為________________。
②已知該晶胞的摩爾質量為M g·mol-1,密度為d g·cm-3。設NA為阿伏加德羅常數的值,則該晶胞的體積是________ cm3(用含M、d、NA的代數式表示)。
③該晶體的內部具有空隙,且每個晶胞的空隙中儲存6個氫原子比較穩定。已知:a=511 pm,c=397 pm;標準狀況下氫氣的密度為8.98×10-5 g·cm-3;儲氫能力= 。若忽略吸氫前后晶胞的體積變化,則該儲氫材料的儲氫能力為_______。
。若忽略吸氫前后晶胞的體積變化,則該儲氫材料的儲氫能力為_______。
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月模擬三理綜化學試卷(解析版) 題型:選擇題
醛或酮與氰化鈉、氯化銨反應,生成氨基腈,經水解生成氨基酸鹽,是制備氨基酸鹽的一種簡便方法,反應過程如下:

下列有關該反應說法不合理的是( )
A.反應①是加成反應
B.反應②需要在酸性環境中進行
C.反應②為堿性環境時,產物結構簡式是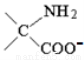
D.經過上述反應,苯乙醛可以制得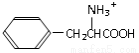
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三下學期猜題理綜化學試卷(解析版) 題型:選擇題
向0.1mol/I.的NH4HCO3溶液中逐漸加入0.1mol/LNaOH溶液時,含氮、含碳粒子的分布情況如圖所示(縱坐標是各粒子的分布系數,即物質的量分數)。根據圖象,下列說法不正確的是( )

A.開始階段,HCO3-反而略有增加,可能是因為NH4HCO3溶液中存在H2CO3發生的主要反應是H2CO3+OH-═HCO3-+H2O
B.當pH大于8.7以后,碳酸氫根離子和銨根離子同時與氫氧根離子反應
C.pH=9.5時,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-)
D.滴加氫氧化鈉溶液時,首先發生的反應為2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三高考打靶測試理綜化學試卷(解析版) 題型:推斷題
【化學選修5:有機化學基礎】化合物X是一種環境激素,存在如下轉化有關系:
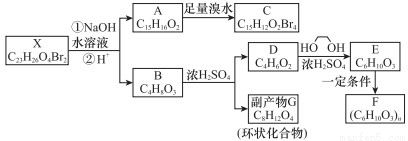
已知:①1H-NMR譜顯示化合物G的所有氫原子化學環境相同;
②F是一種可用于制備隱形眼鏡的高聚物。
根據以上信息回答下列問題
(1)化合物X的分子所含官能團的名稱___________________________________;
(2)化合物C的分子式是___________,A→C的反應類型是_______________;
(3)化合物D的名稱是________________;同時滿足下列條件的D的所有同分異構體的結構簡式(不考慮立體異構)_________有種;
a.屬于酯類 b.能發生銀鏡反應
其中的一個同分異構體核磁共振氫譜為三組峰,且峰的面積比為1:2:3,寫出這種同分異構體的結構簡式____________________;
(4)寫出B→G反應的化學方程式____________________;
(5)寫出F的結構簡式____________________。
查看答案和解析>>
科目:高中化學 來源:2016屆遼寧省高三全真模擬理綜化學試卷(解析版) 題型:填空題
甲醇是重要的化工原料,又可稱為燃料。工業上利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主要反應如下:
①CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58kJ•mol-1
CH3OH(g)+H2O(g) △H2=-58kJ•mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41kJ•mol-1
CO(g)+H2O(g) △H3=+41kJ•mol-1
回答下列問題:
(1)已知反應①中的相關的化學鍵鍵能數據如下:

則x=____________;
(2)若T℃時將6molCO2和8molH2充入2L密閉容器中發生反應②,測得H2的物質的量隨時間變化關系如圖中狀態I(圖中實線)所示。圖中數據A(1,6)代表在1min時H2的物質的量是6mol。
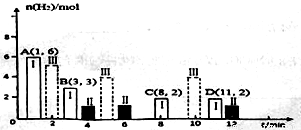
①T℃時狀態I條件下,0~3min內CH3OH的平均反應速率v=_______mol/(L·min),平衡常數K=_____;
②其他條件不變時,僅改變某一條件后測得H2的物質的量隨時間變化如圖中狀態Ⅱ所示,則改變的條件可能是_____;
③其他條件不變,僅改變溫度時,測得H2的物質的量隨時間變化如圖中狀態Ⅲ所示,則狀態Ⅲ對應的溫度_______(填“>”、“<”或“=”)T℃;
④若狀態Ⅱ的平衡常數為K2,狀態Ⅲ的平衡常數為K3,則K2_______(填“>”、“<”或“=”)K3;
⑤一定溫度下同,此反應在恒容容器中進行,能判斷該反應達到化學平衡依據的是_______。
a.容器中壓強不變
b.甲醇和水蒸汽的體積比保持不變
c.v正(H2)=3v逆CH3OH)
d.2個C=O斷裂的同時有6個H—H斷裂
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省高二6月月考化學試卷(解析版) 題型:推斷題
聚戊二酸丙二醇酯(PPG)是一種可降解的聚酯類高分子材料,在材枓的生物相存性方面有很好的應用前景. PPG的一種合成路線如下:

已知:
①烴A的相對分子質量為70,核磁共振氫譜顯示只有一種化學環境的氫;
②化合物B為單氯代烴,化合物C的分子式為C5H8;
③E、F為相對分子質量差14的同系物,F是福爾馬林的溶質;
④R1CHO+R2CH2CHO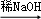
回答下列問題:
(1)A的結構簡式為 .
(2)由B生成C的化學方程式為 .
(3)由E和F生成G的反應類型為 ,A的化學名稱為 .
(4)①由D和H生成PPG的化學方程式為 .
②若PPG平均相對分子質量為10000,則其平均聚合度約為 (填標號).
a. 48 b. 58 c. 76 d.122
(5)D的同分異構體中能同時滿足下列條件的共有 種(不含立體異構):
①能與飽和NaHCO3溶液反應產生氣體
②既能發生銀鏡反應,又能發生皂化反應.其中核磁共振氫譜顯示為3組峰,且峰面積比為6:1:1的是 (寫構簡式)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com