
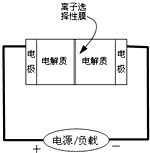
 如圖是一種正在投入生產的大型蓄電系統的原理圖.電池中的左右兩側為電極,中間為離子選擇性膜,在電池放電和充電時該膜只允許鈉離子通過.電池充、放電的化學反應方程式為:2Na2S2+NaBr3$?_{放電}^{充電}$Na2S4+3NaBr.下列關于此電池說法正確的是( )
如圖是一種正在投入生產的大型蓄電系統的原理圖.電池中的左右兩側為電極,中間為離子選擇性膜,在電池放電和充電時該膜只允許鈉離子通過.電池充、放電的化學反應方程式為:2Na2S2+NaBr3$?_{放電}^{充電}$Na2S4+3NaBr.下列關于此電池說法正確的是( )| A. | 充電的過程中當0.1molNa+通過離子交換膜時,導線通過0.2mol電子 | |
| B. | 放電過程中鈉離子從右到左通過離子交換膜 | |
| C. | 電池放電時,負極反應為:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充電過程中鈉離子從右到左通過離子交換膜 |
分析 電池充、放電的化學反應方程式為:2Na2S2+NaBr3$?_{充電}^{放電}$Na2S4+3NaBr,放電時為原電池反應:負極反應為2Na2S2-2e-=2Na++Na2S4,正極反應為NaBr3+2Na++2e-=3NaBr;
充電時為電解池反應:陽極電極反應為:3NaBr-2e-=NaBr3+2Na+,陰極電極反應為:2Na++Na2S4+2e-=2Na2S2,結合原電池原理和電解原理分析判斷.
解答 解:A、有0.1molNa+通過離子交換膜,說明有0.1mol電子轉移,導線通過0.1mol電子,故A錯誤;
B、放電過程為原電池,陽離子向正極移動,由圖可知,左側電極為正極,放電過程中鈉離子從右到左通過離子交換膜,故B正確;
C、電池放電時,正極反應為得到電子發生的還原反應,正極反應為:NaBr3+2Na++2e-=3NaBr,負極反應氧化反應,負極電極反應式為2Na2S2-2e-=2Na++Na2S4,故C錯誤;
D、充電過程為電解池,陽離子向陰極移動,由圖可知,右側電極為陰極,充電過程中鈉離子從左到右通過離子交換膜,故D錯誤;
故選B.
點評 本題考查了原電池和電解池的工作原理應用,電極反應電極判斷是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 水分子中共價鍵比氯化鈉中離子鍵弱 | |
| B. | 水的相對分子質量比氯化鈉的小 | |
| C. | 水分子間有范德華力,氯化鈉分子間的作用力較強 | |
| D. | 水分子間是以范德華力相結合,相互作用較弱;氯化鈉晶體中,Na+和Cl-以離子鍵相結合,作用力較強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用Br2的CCl4溶液鑒別CH2=CH2和HC≡CH | |
| B. | 用AgNO3溶液鑒別KCl溶液和MgCl2溶液 | |
| C. | 用丁達爾效應鑒別Fe(OH)3膠體和FeCl3溶液 | |
| D. | 用酚酞溶液鑒別未知濃度的NaOH溶液和Na2CO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
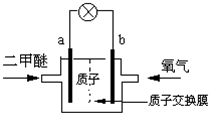 新能源開發中的燃料電池是低碳研究的重要領域.
新能源開發中的燃料電池是低碳研究的重要領域.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有一未知的無色溶液,可能含有以下離子中的若干種(忽略由水電離產生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,現取兩份100mL溶液進行如下實驗:
有一未知的無色溶液,可能含有以下離子中的若干種(忽略由水電離產生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,現取兩份100mL溶液進行如下實驗:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙呈紅色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com