
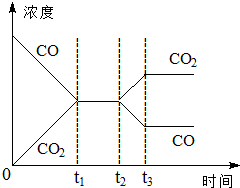
 在一個恒容反應器中發生反應:CO(g)+H2O(g)?H2(g)+CO2(g),該反應的平衡常數隨溫度的變化如表:
在一個恒容反應器中發生反應:CO(g)+H2O(g)?H2(g)+CO2(g),該反應的平衡常數隨溫度的變化如表:| 溫度/℃ | 400 | 500 | 830 |
| 平衡常數K | 10 | 9 | 1 |
分析 (1)由表中數據可知升高溫度平衡常數減小,說明平衡逆向移動,以此判斷反應熱;
(2)830℃時,化學平衡常數K=1.根據若使反應開始時向逆反應方向進行,則應濃度商Qc>K,據此分析;
(3)在一個絕熱的固定容積的容器中:①此反應是個氣體的物質的量不變的反應,但容器絕熱,此反應為放熱反應,故體系的溫度在不斷升高;②混合氣體的質量不變,又是恒容的容器,據此分析;③混合氣體的平均相對分子質量$\overline{M}$=$\frac{{m}_{氣體總質量}}{{n}_{氣體總物質的量}}$;④各組分的物質的量濃度不再改變,說明一種物質的消耗速率等于其生成速率;⑤消耗1mol H2O(g)和生成1mol CO2(g)是同方向.
(4)在t2時刻因改變某個條件濃度發生變化的情況是二氧化碳濃度增大,一氧化碳濃度減小,結合平衡移動原理分析.
解答 解:(1)由表可知,溫度越高,平衡常數越小,反應進行程度越小,平衡向逆反應移動,升高溫度平衡向吸熱方向移動,故正反應為放熱反應,故答案為:放熱;
(2)830℃時,化學平衡常數K=1.根據若使反應開始時向逆反應方向進行,則應濃度商Qc>K,設容器體積VL,即有:$\frac{\frac{0.5mol}{VL}×\frac{xmol}{VL}}{\frac{1mol}{VL}×\frac{2mol}{VL}}$>1,解得x>4,故答案為:x>4;
(3)在一個絕熱的固定容積的容器中:①此反應是個氣體的物質的量不變的反應,但容器絕熱,此反應為放熱反應,故體系的溫度在不斷升高,故在平衡之前,容器的壓強在不斷增大,當壓強不變時說明反應達平衡,故①正確;
②混合氣體的質量不變,又是恒容的容器,故混合氣體的密度自始至終不再發生變化,密度不能作為平衡狀態的標志,故②錯誤;
③混合氣體的平均相對分子質量$\overline{M}$=$\frac{{m}_{氣體總質量}}{{n}_{氣體總物質的量}}$自始至終不發生變化,平均相對分子質量不能作為平衡狀態的標志,故③錯誤;
④各組分的物質的量濃度不再改變,說明一種物質的消耗速率等于其生成速率,反應達到平衡,故④正確;
⑤耗1mol H2O(g)和生成1mol CO2(g)是同方向,故消耗1mol H2O(g)的同時,生成1mol CO2(g)是必然的,不能作為平衡的標志,故⑤錯誤;
故答案為:①④;
(4)反應是氣體體積不變的放熱反應,在t2時刻因改變某個條件濃度發生變化的情況是二氧化碳濃度增大,一氧化碳濃度減小,說明平衡正向進行,降低溫度,或增加水蒸氣的量或減少氫氣的量均可以實現,
故答案為:降低溫度,或增加水蒸汽的量,或減少氫氣的量.
點評 本題考查了化學平衡的分析判斷,圖象分析方法,平衡常數的計算應用,平衡移動原理的理解和影響因素的分析是解題關鍵,題目難度中等.


 英才點津系列答案
英才點津系列答案 紅果子三級測試卷系列答案
紅果子三級測試卷系列答案 課堂練加測系列答案
課堂練加測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2SO4═Na++SO4-2 | B. | BaCl2═Ba2++Cl2- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | K2S═2K+S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuCl2溶液 | B. | KCl溶液 | C. | H2SO4溶液 | D. | K2SO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
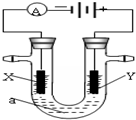 電解原理在化學工業中有廣泛應用.下圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液.請回答以下問題:
電解原理在化學工業中有廣泛應用.下圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①和③ | C. | ②和③ | D. | ①和② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
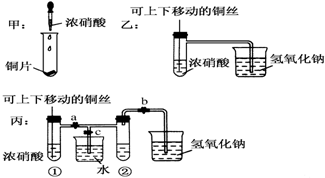
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com