
阿魏酸在食品、醫藥等方面有著廣泛用途。一種合成阿魏酸的反應可表示為

下列說法正確的是
A.可用酸性KMnO4溶液檢測上述反應是否有阿魏酸生成
B.香蘭素、阿魏酸均可與Na2CO3、NaOH溶液反應
C.通常條件下,香蘭素、阿魏酸都能發生取代、加成、消去反應
D.1mol香蘭素最多可以與4molH2發生加成反應
 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案 小學期末標準試卷系列答案
小學期末標準試卷系列答案科目:高中化學 來源:2016屆湖南省常德市高三上學期第三次月考化學試卷(解析版) 題型:選擇題
下列類比關系正確的是
A.鈉與氧氣反應可生成兩種不同的氧化物,則Li與氧氣反應反應也能生成Li2O或Li2O2
B.Na2O2與CO2反應生成Na2CO3和O2,則Na2O2與SO2反應可生成Na2SO3和O2
C.Fe與Cl2反應生成FeCl3,則Fe與I2反應可生成FeI3
D.Al與Fe2O3能發生鋁熱反應,則Al與MnO2也能發生鋁熱反應
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二上學期9月月考化學試卷(解析版) 題型:選擇題
在25℃、1.01×105Pa時,1gCH4燃燒時生成CO2與液態H2O,放出55.6kJ的熱量,則CH4的燃燒熱為
A.55.6kJ/mol B.889.6kJ/mol C.-889.6kJ/mol D.444.8kJ/mol
查看答案和解析>>
科目:高中化學 來源:2016屆江西省高三上學期第一次月考化學試卷(解析版) 題型:填空題
有下列化學儀器:①量筒 ②燒杯 ③容量瓶 ④膠頭滴管 ⑤細口試劑瓶 ⑥標簽紙
(1)現需要配制500 mL 1 mol·L-1的硫酸溶液,需用質量分數為98%、密度為1.84 g·cm-3的濃硫酸______mL。
(2)從上述儀器中,按實驗使用的先后順序,其編號排列是_______________
(3)容量瓶使用前應進行的操作是_______________
(4)若實驗遇到下列情況,對硫酸溶液的物質的量濃度的影響 ,下列判斷正確的是___________
①用量筒量取硫酸時俯視讀數 ②稀釋濃硫酸的燒杯中原有少量蒸餾水;
A.①偏低 ②不變 B.①偏低 ②偏低 C.①偏高 ②偏低 D.①偏高 ②不變
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧實驗中學高一上10月階段測化學試卷(解析版) 題型:選擇題
某飽和氯化鈉溶液的體積為VmL,密度為ρg/cm3,質量分數為w,物質的量濃度為c mol/L,溶液中所含氯化鈉的質量為m g。下列選項正確的是
A.該溫度下,氯化鈉的溶解度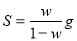
B.溶液中溶質的物質的量濃度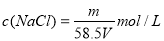
C.溶液中溶質物質的量濃度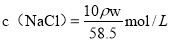
D.溶液中溶質的質量分數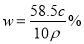
查看答案和解析>>
科目:高中化學 來源:2016屆上海市高三上學期摸底測試化學試卷(解析版) 題型:選擇題
互為同位素的兩種原子不可能具有
A.相同的電子數 B.相同的中子數
C.幾乎完全相同的化學性質 D.相同的質子數
查看答案和解析>>
科目:高中化學 來源:2016屆江西省南昌市高三上學期第一次月考化學試卷(解析版) 題型:推斷題
(8分)A、B、C、D、E、F六種物質在一定條件下有如下圖所示的相互轉化關系。
(1)若下列反應①為不同短周期、不同主族元素間置換反應,A、D為固體單質,其中D為非金屬。則反應①的化學方程式為

(2)若下列反應②中E為一種一元強堿, C的大量排放產生溫室效應。則在反應②中,若C、E的物質的量之比為11:17,則反應的離子方程式為
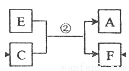
(3)若下列反應③中B為一種淡黃色固體,綠色植物的光合作用和呼吸作用可實現自然界中E的循環。則B的電子式為 反應③的化學方程式為
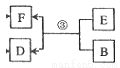
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二上第二次月考化學試卷(解析版) 題型:實驗題
(每空2分,共10分)某同學用中和滴定法測定某燒堿的純度,實驗過程如下:
(1)配制待測液:稱取4.1 g固體燒堿樣品(雜質不與酸反應)配制成250 mL溶液。
(2)滴定
①用______________量取10.00 mL待測液。
②向錐形瓶中加入幾滴酚酞,用0.201 0 mol·L-1的標準鹽酸滴定待測燒堿溶液,邊滴邊搖動錐形瓶,眼睛注視錐形瓶內溶液顏色的變化,直到_______________________時停止滴定。
(3)數據處理
實驗次 序編號 | 鹽酸溶液體積 V/mL | 氫氧化鈉溶液體積 V/mL |
1 | 19.90 | 10.00 |
2 | 20.10 | 10.00 |
3 | 22.00 | 10.00 |
4 | 20.00 | 10.00 |
根據上述表格,選取合適的數據,計算待測燒堿溶液的濃度為_____________,燒堿的純度為___________(保留兩位小數)。
(4)一定物質的量濃度溶液的配制和酸堿中和滴定是中學化學中兩個典型的定量實驗。某研究性學習小組在實驗室中配制鹽酸標準溶液,然后用其滴定某未知濃度的NaOH溶液。下列有關說法中正確的是(多選)
A.實驗中所用到的滴定管、容量瓶,在使用前均需要檢漏
B.如果實驗中需用80 mL的稀鹽酸標準溶液,配制時應選用100 mL容量瓶
C.容量瓶中含有少量蒸餾水,會導致所配標準溶液的濃度偏小
D.酸式滴定管用蒸餾水洗滌后,即裝入標準濃度的稀鹽酸,則測得的NaOH溶液的濃度將偏大
E.配制溶液時,定容時俯視讀數,則導致實驗結果偏大
F.中和滴定時,若在最后一次讀數時俯視讀數,則導致實驗結果偏大
G.錐形瓶用蒸餾水洗浄后,有少量蒸餾水殘留,則導致實驗結果偏小
H.滴定前滴定管尖嘴有氣泡,滴定后氣泡消失,則導致實驗結果偏大
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省高二上10月月考化學試卷(解析版) 題型:填空題
(10分)在 1.0L恒容密閉容器中放入0.10 mol A (g),在一定溫度進行如下反應。A(g) 2B(g)+ C(g)+ D(s)△H= + 85.1 kJ / mol
2B(g)+ C(g)+ D(s)△H= + 85.1 kJ / mol
容器內氣體總壓強(P)與起始壓強P。的比值隨反應時間(t)變化數據見下表(提示:密閉容器中的壓強比等 于氣體物質的量之比)。
時間t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列問題:
(1)下列能提高 A 的轉化率的是 。
A.升高溫度 B.向體系中通人A氣體
C.減少D的物質的量 D.向體系中通人稀有氣體He
(2)反應進行1小時,容器中剩余A的物質的量為 mol。
(3)平衡時A的轉化率為
(4)相同條件下,若該反應從逆向開始,建立與上述相同的化學平衡,則 D 的取值范圍n(D)mol。
(5)將容器改為恒壓容器,改變條件,使反應達到相同的限度,則達到平衡時B的濃度為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com