
【題目】已知:![]() 時,
時,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 。
。
![]() 溶液和NaHA溶液反應的主要離子方程式為________________________________
溶液和NaHA溶液反應的主要離子方程式為________________________________![]() 不考慮
不考慮![]() 與
與![]() 發生氧化還原反應
發生氧化還原反應![]() 。
。
![]() 溶液中離子濃度由大到小的順序為 ____________________________。
溶液中離子濃度由大到小的順序為 ____________________________。
![]() 時,將
時,將![]() 的HCOOH溶液和
的HCOOH溶液和![]() 的
的![]() 溶液分別與
溶液分別與![]() 的
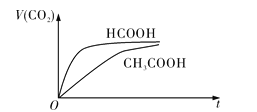
的![]() 溶液混合,實驗測得產生的氣體體積
溶液混合,實驗測得產生的氣體體積![]() 隨時間
隨時間![]() 變化的示意圖如圖所示:
變化的示意圖如圖所示:
![]() 的電離平衡常數表達式
的電離平衡常數表達式![]() __________________________。
__________________________。
![]() 反應初始階段,兩種溶液產生
反應初始階段,兩種溶液產生![]() 氣體的速率存在明顯差異的原因是__________________________________________________________________________________,反應結束后所得兩溶液中,
氣體的速率存在明顯差異的原因是__________________________________________________________________________________,反應結束后所得兩溶液中,![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 時,某溶液中含有
時,某溶液中含有![]() 、
、![]() 加入KOH固體以調節溶液
加入KOH固體以調節溶液![]() 忽略溶液體積的變化、忽略
忽略溶液體積的變化、忽略 ![]() 的揮發和分解
的揮發和分解![]() 。當pH為7時,能否有
。當pH為7時,能否有![]() 沉淀生成?________
沉淀生成?________![]() 填“能”或“否”
填“能”或“否”![]() 。
。
【答案】![]()
![]()
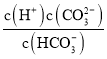
![]() 的酸性比
的酸性比![]() 強,等濃度的HCOOH溶液中的
強,等濃度的HCOOH溶液中的![]() 較大,故其溶液與
較大,故其溶液與![]() 溶液的反應速率較快
溶液的反應速率較快 ![]() 能
能
【解析】
![]() ,
,![]() ,
,![]() ,則
,則![]() ,電離平衡常數越大酸性越強,強酸可以制弱酸;
,電離平衡常數越大酸性越強,強酸可以制弱酸;
(2)![]() 溶液中存在亞硫酸根的水解和亞硫酸氫根的水解,且第一步水解大于第二步水解,溶液呈堿性;
溶液中存在亞硫酸根的水解和亞硫酸氫根的水解,且第一步水解大于第二步水解,溶液呈堿性;
(3)![]() 根據電離方程式可知K=
根據電離方程式可知K=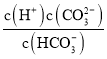 ;
;
![]() 的濃度越大反應速率越快,且酸溶液的酸越弱,反應生成的相應的鈉鹽越易水解;
的濃度越大反應速率越快,且酸溶液的酸越弱,反應生成的相應的鈉鹽越易水解;
(4)根據pH值和![]() 計算出亞硫酸根的濃度,當
計算出亞硫酸根的濃度,當![]() ,則能生成沉淀,根據pH值和
,則能生成沉淀,根據pH值和![]() 計算出亞硫酸根的濃度。
計算出亞硫酸根的濃度。
![]() ,
,![]() ,
,![]() ,則
,則![]() ,亞硫酸可以制得
,亞硫酸可以制得![]() ,同時生成亞硫酸氫根,離子方程式為:
,同時生成亞硫酸氫根,離子方程式為:![]() ,故答案為:
,故答案為:![]() ;
;
![]()
![]() ,故答案為:
,故答案為:![]() ;
;
![]() 碳酸氫根離子電離方程式為:
碳酸氫根離子電離方程式為:![]() ,則電離平衡常數表達式為K=
,則電離平衡常數表達式為K=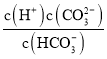 ,故答案為:
,故答案為: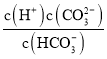 ;
;
![]() 的酸性弱于HCOOH的,即在相同濃度的情況下HCOOH溶液中
的酸性弱于HCOOH的,即在相同濃度的情況下HCOOH溶液中![]() 的濃度大于
的濃度大于![]() 溶液中
溶液中![]() 的濃度,濃度越大反應速率越快,且酸溶液的酸越弱,反應生成的相應的鈉鹽越易水解,所以反應結束后
的濃度,濃度越大反應速率越快,且酸溶液的酸越弱,反應生成的相應的鈉鹽越易水解,所以反應結束后![]() ,故答案為:HCOOH的酸性比
,故答案為:HCOOH的酸性比![]() 強,等濃度的HCOOH溶液中的
強,等濃度的HCOOH溶液中的![]() 較大,故其溶液與
較大,故其溶液與![]() 溶液的反應速率較快;
溶液的反應速率較快;![]() ;
;
![]() 當pH為7時,
當pH為7時,![]() ,S元素的存在形式為
,S元素的存在形式為![]() 、
、![]() ,
,![]() ,又
,又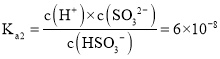 ,聯立可得
,聯立可得![]() ,
,![]() ,則能生成沉淀,故答案為:能。
,則能生成沉淀,故答案為:能。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】25℃時,用濃度為0.1000mol·L-1的NaOH溶液滴定20.00mL濃度為0.1000mo l·L-1的某酸HX,滴定曲線如圖所示。下列說法正確的是( )

A. HX的電離常數Ka的數量級為10-10
B. P點溶液中微粒濃度大小為:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定過程中可選用的指示劑有甲基橙和酚酞
D. A點到B點過程中,水電離出的c(H+)×c(OH-)先增大,后不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有下列幾組物質,請將序號填入下列空格內:
A、CH2=CH-COOH和油酸(C17H33COOH) B、12C60和石墨 C、![]() 和
和![]() D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇
①互為同系物的是________;
②互為同分異構體的是________;
③既不是同系物,又不是同分異構體,也不是同素異形體,但可看成是同一類物質的是________。
(2)有8種物質:A乙烷;B乙烯;C乙炔;D苯;E甲苯;F溴乙烷;G聚丙烯;H環己烯。
其中既不能使酸性KMnO4溶液褪色,也不能與溴水反應使溴水褪色的是________;
(3)寫出![]() 聚合物的單體結構簡式________和________。
聚合物的單體結構簡式________和________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作或敘述錯誤的是

A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開K
B. 實驗中裝置b中的液體逐漸變為淺紅色
C. 裝置c中的碳酸鈉溶液的作用是吸收溴化氫
D. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列裝置進行相應實驗,能達到實驗目的的是
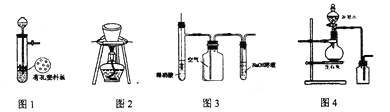
A. 圖1所示裝置用于Cu和濃硫酸反應制取少量的SO2氣體
B. 圖2裝置用于除去碳酸氫鈉固體中的少量碳酸鈉
C. 圖3裝置用于制備并收集NO氣體
D. 圖4所示裝置制取并收集氨氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 為阿伏加德羅常數的值,下列敘述正確的是
為阿伏加德羅常數的值,下列敘述正確的是
A.常溫常壓下,![]() 甲基
甲基![]() 中含有的中子數為
中含有的中子數為![]()
B.將![]() 溶于稀氨水中,所得溶液呈中性,則溶液中
溶于稀氨水中,所得溶液呈中性,則溶液中![]() 的數目為
的數目為![]()
C.![]() 和
和![]() 在催化劑和加熱條件下充分反應生成NO的分子數為
在催化劑和加熱條件下充分反應生成NO的分子數為![]()
D.常溫下,![]() 的
的![]() 溶液中,發生電離的水分子數為
溶液中,發生電離的水分子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作或對實驗事實的敘述正確的有幾個( )
①用濃氨水清洗做過制備AgCl反應后的試管;②配制一定物質的量濃度的溶液時,未振蕩搖勻則溶液濃度偏高;③用濕潤的pH試紙測定稀鹽酸的pH;④用堿式滴定管量取20.00mL0.1mol/LKMnO4溶液;⑤將Na2CO3固體在瓷坩堝中加熱熔融;⑥不慎將苯酚溶液沾到皮膚上,立即用NaOH稀溶液清洗;⑦向沸騰的NaOH溶液中滴加FeCl3溶液制備Fe(OH)3膠體;⑧配制FeSO4溶液時,需加入少量鐵粉和稀鹽酸
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】公元八世紀,Jabir ibn Hayyan在干餾硝石的過程中首次發現并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同時他也是硫酸和王水的發現者。下列說法正確的是
2K2O+4NO↑+3O2↑),同時他也是硫酸和王水的發現者。下列說法正確的是
A. 干餾產生的混合氣體理論上可被水完全吸收
B. 王水是由3體積濃硝酸與1體積濃鹽酸配制而成的
C. 王水溶解金時,其中的鹽酸作氧化劑(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 實驗室可用NaNO3與濃硫酸反應制備少量的HNO3,利用的是濃硫酸的氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,可逆反應2A(g)![]() B(g)+3C(g),反應處于平衡狀態的是( )
B(g)+3C(g),反應處于平衡狀態的是( )
選項 | 正反應速率 | 逆反應速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com