
分析 依據原電池工作原理解答:原電池是將氧化還原反應分成兩個半反應,分別在兩個電極發生,將化學能轉化為電能的裝置,原電池負極為電子流出極,發生氧化反應,正極為電子流入極,發生還原反應,外電路電子在導線中定向移動,內電路中電解質中的陰陽離子定向移動,形成閉合回路;
根據電池總反應可知,放電時,Fe被氧化生成Fe(OH)2,電極反應式為Fe-2e-+2OH-=Fe(OH)2,正極NiO2得電子被還原生成Ni(OH)2,電極反應式為NiO2+2H2O+2e-=Ni(OH)2+2OH-,充電時電能轉化為化學能,電極反應與原電池電極反應相反,以此解答該題.
解答 解:原電池是將氧化還原反應分成兩個半反應,分別在兩個電極發生,將化學能轉化為電能的裝置,原電池負極為電子流出極,發生氧化反應,正極為電子流入極,發生還原反應,外電路電子在導線中定向移動,內電路中電解質中的陰陽離子定向移動,形成閉合回路;
某可逆電池的總反應方程式為:Fe+NiO2+2H2O $\stackrel{KOH}{?}$Fe(OH)2+Ni(OH)2,電解液是氫氧化鉀溶液,放電時,Fe是還原劑,被氧化生成Fe(OH)2,電極反應式為Fe-2e-+2OH-=Fe(OH)2,放電時氧化劑是NiO2得電子被還原生成Ni(OH)2,電極反應式為NiO2+2H2O+2e-=Ni(OH)2+2OH-,
故答案為:氧化還原反應;化學;電;負;氧化;正;還原;使溶液導電,形成閉合回路;氫氧化鉀溶液;Fe;Fe-2e-+2OH-=Fe(OH)2;NiO2;NiO2+2H2O+2e-=Ni(OH)2+2OH-.
點評 本題考查了原電池工作的原理,題目難度不大,側重考查學生對基礎知識的掌握.


科目:高中化學 來源: 題型:選擇題
| A. | 元素原子半徑大小呈周期性變化 | |
| B. | 元素原子量依次遞增 | |
| C. | 元素的最高正化合價呈周期性變化 | |
| D. | 元素原子最外層電子排布呈周期性變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸、空氣、醋酸、干冰 | B. | 冰醋酸、堿石灰、硫酸鈉、乙醇 | ||
| C. | 蛋白質、油脂、苛性鈉、石灰石 | D. | 膽礬、漂白粉、氯化鉀、硫酸鋇 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
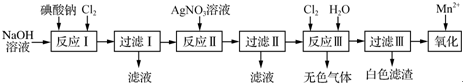
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
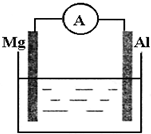 如圖所示裝置
如圖所示裝置 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;B的結構簡式為
;B的結構簡式為 ;與A含有相同種類和數目的官能團(包括苯環)、且苯環上取代基位置和數量也相同的同分異構體有多種,寫出其中任意一種的結構簡式
;與A含有相同種類和數目的官能團(包括苯環)、且苯環上取代基位置和數量也相同的同分異構體有多種,寫出其中任意一種的結構簡式 (不包括原化合物,不考慮立體異構).
(不包括原化合物,不考慮立體異構).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com