
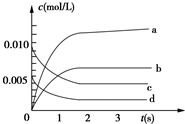
 在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如表:
在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如表:| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)c(NO)=$\frac{n(NO)}{V}$.
(2)v=$\frac{△c}{△t}$.
(3)化學平衡狀態的判斷:正反應速率與逆反應速率相等.對于氣體體積變化的可逆反應,當密閉容器中壓強不變時,反應達到平衡狀態.
(4)增大反應速率的方法:適當提高反應溫度,增大反應物濃度,選擇高效催化劑.
解答 解:(1)平衡時n(NO)=0.007mol,容器體積2L,所以c(NO)=$\frac{n(NO)}{V}$=$\frac{0.007mol}{2L}$=0.0035mol/L,
故答案為:0.0035mol/L;
(2)根據一氧化氮物質的量的變化知,該反應向正反應方向移動,則二氧化氮的物質的量在不斷增大,且同一時間段內,一氧化氮減少的物質的量等于二氧化氮增加的物質的量,所以表示NO2的變化的曲線是b,0~2s內v(NO)=$\frac{\frac{0.020-0.008}{2}}{2}$ mol/(L.s)=0.0030mol/(L.s),同一化學反應同一時間段內,各物質的反應速率之比等于其計量數之比,所以氧氣的反應速率為 0.0015mol/(L•s)
故答案為:b;1.5×10-3 mol/(L•s);
(3)a、無論反應是否達到平衡狀態,v(NO2)=2v(O2)始終存在,故a錯誤;
b、該反應是氣體體積變化的反應,所以該反應 受壓強的影響,只要壓強不再變化,反應就達平衡狀態,故b正確;
c、v正(NO)=2v逆(O2),正逆反應符合系數比,故c正確;
d、根據質量守恒,反應前后質量不變,容器的體積不變,所以密度始終不變,故d錯誤;
故答案為:b、c;
(4)a.增大體積,濃度降低,化學反應速率減小,故a錯誤;
b.升高溫度,化學反應速率加快,故b正確;
c.增大O2的濃度,化學反應速率加快,故c正確;
d.選擇高效的正催化劑,可以加快反應速率,故d正確;
故答案為:bcd.
點評 本題主要考察化學反應速率、化學平衡以及影響速率和平衡的因素,綜合性較強.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 乙烯與苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1 mol乙烯與Cl2完全加成,然后與Cl2發生取代反應,共消耗氯氣5mol | |
| C. | 溴水遇到乙醛溶液出現褪色現象,是因為它們發生了氧化反應 | |
| D. | 二氯甲烷存在兩種不同的結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用敞口容器稱量NaOH且時間過長 | |
| B. | 定容時俯視讀取刻度 | |
| C. | 原容量瓶洗凈后未干燥 | |
| D. | 配制過程中,未用蒸餾水洗滌燒杯和玻璃棒 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
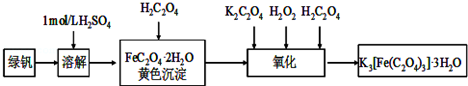
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
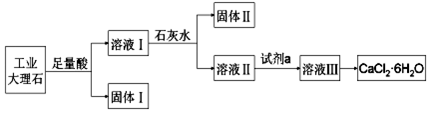
| A. | 固體Ⅰ中含有SiO2 | |
| B. | 使用石灰水時,要控制pH,防止固體Ⅱ中Al(OH)3轉化為[Al(OH)4]- | |
| C. | 試劑a選用鹽酸,從溶液Ⅲ得到CaCl2•6H2O的過程中,須控制條件防止其分解 | |
| D. | 若改變實驗方案,在溶液Ⅰ中直接加氨水至沉淀完全,濾去沉淀,其溶液經蒸發濃縮、冷卻結晶也可得到純凈CaCl2•6H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com