
 ,并簡要說明理由:增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大.
,并簡要說明理由:增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大.| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
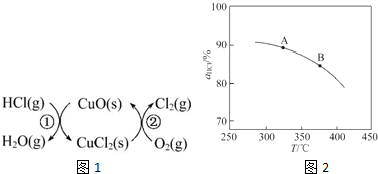
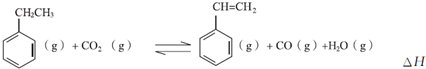
分析 (1)由圖示可知,整個過程為:4HCl+O2=2Cl2+2H2O,反應②生成1molCl2(g)的反應熱為△H2,則反應熱化學方程式為:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,根據蓋斯定律(①+②)×2可得總反應的熱化學方程式;
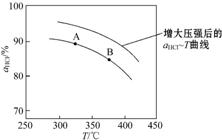
(2)①由圖可知,溫度越高,平衡時HCl的轉化率越小,說明升高溫度平衡向逆反應方向移動;
②正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,相同溫度下HCl的平衡轉化率比之前實驗的大;
③改變措施有利于提高αHCl,應使平衡向正反應方向移動,注意不能只增加HCl的濃度;
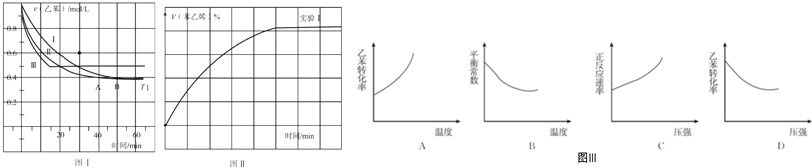
(3)根據v=$\frac{△n}{△t}$計算2.0~6.0min內v(Cl2),再利用速率之比等于其化學計量數之比計算v(HCl);
(4)氯氣與氫氧化鈣反應生成氯化鈣、次氯酸鈣與水.
解答 解:(1)由圖示可知,整個過程為:4HCl+O2=2Cl2+2H2O,反應①為:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,
反應②生成1molCl2(g)的反應熱為△H2,則反應熱化學方程式為:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,
根據蓋斯定律(①+②)×2可得總反應的熱化學方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2),
故答案為:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2);
(2)①由圖可知,溫度越高,平衡時HCl的轉化率越小,說明升高溫度平衡向逆反應方向移動,則正反應為放熱反應,即△H<0,化學平衡常數減小,即K(A)>K(B),
故答案為:<;K(A);
②正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,相同溫度下HCl的平衡轉化率比之前實驗的大,故壓縮體積使壓強增大,畫相應αHCl~T曲線的示意圖為 ,
,
故答案為: ,增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大;
,增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大;
③A.增大n(HCl),HCl濃度增大,平衡右移,但HCl的轉化率降低,故A錯誤;
B.增大n(O2),氧氣濃度增大,平衡右移,HCl的轉化率提高,故B正確;
C.使用更好的催化劑,加快反應速率,縮短到達平衡的時間,不影響平衡移動,HCl的轉化率不變,故C錯誤;
D.移去生成物H2O,有利于平衡右移,HCl的轉化率增大,故D正確,
故選:BD;
(3)由表中數據可知,2.0~6.0min內△n(Cl2)=(5.4-1.8)×10-3mol=3.6×10-3mol,則以Cl2的物質的量變化表示的反應速率v(Cl2)=$\frac{3.6×1{0}^{-3}}{6min-2min}$=9×10-4mol•min-1,速率之比等于其化學計量數之比,故v(HCl)=2v(Cl2)=1.8×10-3mol.min-1,
故答案為:1.8×10-3mol•min-1;
(4)氯氣與氫氧化鈣反應生成氯化鈣、次氯酸鈣與水,反應方程式為2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
點評 本題比較綜合,為高頻考點,涉及熱化學方程式書寫、化學平衡及平衡常數影響因素、化學反應速率的計算等,(3)中注意用單位時間內物質的量變化表示速率,較好的考查的分析解決問題的能力,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 如圖表示各物質間的轉化關系.已知A、H為離子化合物,H晶體中陰、陽離子的個數比為2:1,常用作干燥劑,D、E為單質.
如圖表示各物質間的轉化關系.已知A、H為離子化合物,H晶體中陰、陽離子的個數比為2:1,常用作干燥劑,D、E為單質.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 物質 | CH4 | CO2 | CO | H2 |
| 體積分數 | 0.1 | 0.1 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | H2O2 | Na2CO3 | Al(OH)3 | NaCl |
| 用途 | 消毒劑 | 發酵粉 | 抗酸藥 | 調味品 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
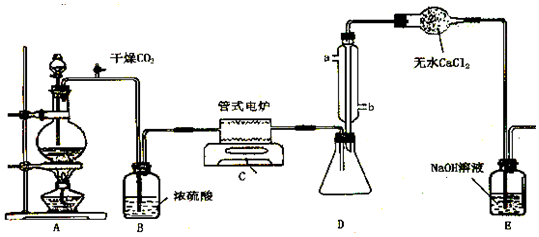
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉和油脂的水解都是高分子生成小分子的過程 | |
| B. | 2-甲基丙烷和異丁烷互為同系物 | |
| C. |  屬于取代反應 屬于取代反應 | |
| D. | C3H4Cl2的鏈狀有機物的同分異構體有5種(不考慮立體異構) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡時體積(L) | V1 | V2 | V3 |
| 反應物轉化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=90.7 | C. | 2V2<V3 | D. | α1+α3=0.75 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com