
| A. | 對于反應2HI(g)?H2(g)+I2(g),增大平衡體系的壓強(壓縮體積),可使體系顏色變深 | |
| B. | 實驗室常用排飽和食鹽水法收集氯氣 | |
| C. | 硫酸工業中,加催化劑有利于三氧化硫的生成 | |
| D. | 2SO2+O2$?_{加熱}^{催化劑}$2SO3的反應條件不是室溫,是500℃左右 |
分析 平衡移動原理是如果改變影響平衡的一個條件(如濃度、壓強或溫度等),平衡就向能夠減弱這種改變的方向移動,平衡移動原理適用的對象應存在可逆過程,如與可逆過程無關,則不能用平衡移動原理解釋,平衡移動原理對所有的動態平衡都適用.
解答 解:A、對于反應2HI(g)?H2(g)+I2(g),兩邊的氣體計量數相等,增大平衡體系的壓強(壓縮體積),平衡不移動,故A錯誤;
B、氯氣和水的反應方程式為:Cl2+H2O?HCl+HClO,該反應是可逆反應,所以可以用勒夏特列原理解釋,故B正確;
C、使用催化劑平衡不移動,故C錯誤;
D、正反應是放熱反應,升高溫度不利于三氧化硫的生成,溫度升高是加快反應速率的,故D錯誤;
故選B.
點評 本題考查勒夏特例原理應用的有關判斷,是高考中的常見題型和考點,屬于中等難度試題的考查.試題難易適中,基礎性強,側重對學生解題能力的培養與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力.該題需要明確的應注意區別化學平衡移動原理和化學反應速率理論的應用范圍,并能具體問題、具體分析加快.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 催化劑V2O5不改變該反應的逆反應速率 | |
| B. | 當v(SO2):v(O2):v(SO3 )=2:1:2時,反應達到平衡狀態 | |
| C. | 該反應是放熱反應,降低溫度將縮短反應達到平衡的時間 | |
| D. | 在t1、t2時刻,SO3(g)的濃度分別是c1、c2,則時間間隔t1~t2內,SO3(g)生成的平均反應速率為v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
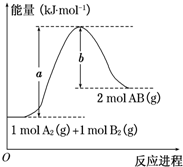 已知化學反應A2(g)+B2(g)═2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )
已知化學反應A2(g)+B2(g)═2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )| A. | 每生成2分子AB吸收b kJ熱量 | |
| B. | 該反應熱△H=+(a-b)kJ•mol-1 | |
| C. | 該反應中反應物的總能量高于生成物的總能量 | |
| D. | 斷裂1 mol A-A和1 mol B-B鍵,放出a kJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | X、Y、Z三種元素中,X的非金屬性最強 | |
| B. | Y的氫化物的穩定性比Z的氫化物弱 | |
| C. | Y的最高正化合價為+7 | |
| D. | X的單質的熔點比Z的低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol苯中含有3nA個碳碳雙鍵 | |
| B. | 室溫下,1LpH=13的NaOH溶液中,由水電離的OH-離子數目為0.1NA | |
| C. | 氫氧燃料電池正極消耗22.4L(標準狀況)氣體時,電路中通過的電子數目為2NA | |
| D. | 一定條件下2 mol SO2和1 mol O2充分反應后,混合氣體的分子總數大于2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com