
分析 (1)①得電子,化合價降低的反應物是氧化劑;
②根據化合價升降總數相等、原子守恒來配平;
(2)①亞鐵離子會和Cr2O72-的酸性廢水反應,發生反應的離子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,結合電極方程式Fe-2e-═Fe2+計算;
②根據溶度積計算;
(3)①加入一定量 Na2S2O3 溶液,發生反應2S2O32-+I2═S4O62-+2I-,使I2還原為I-;
②由圖示表明,pH至1~3時,ClO2-將I-氧化生成的I2與淀粉結合再次出現藍色,根據化合價升降總數相等、原子守恒和電荷守恒來配平;
③根據關系式ClO2~I-~S2O32-先計算出ClO2的物質的量,然后再計算出濃度.
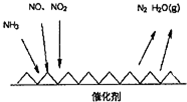
解答 解:(1)①由圖甲可知SCR技術中NH3與NO、NO2反應產物為N2和水,故氧化劑為NO、NO2,
故答案為:NO、NO2;
②NH3中氮的化合價由-3價升高到0價,一個NH3失去3個電子,NO2中氮的化合價由+4價降低到0價,一個NO2得到4個電子,NO中氮的化合價由+2價降低到0價,一個NO得到2個電子,當NO2與NO的物質的量之比為1:1時,轉移電子的最小公倍數為6,結合質量守恒可知方程式為:2NH3+NO+NO2$\frac{Fe}{△}$2N2+3H2O,
故答案為:2NH3+NO+NO2$\frac{Fe}{△}$2N2+3H2O;
(2)①亞鐵離子會和Cr2O72-的酸性廢水反應,發生反應的離子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,陽極電極方程式Fe-2e-═Fe2+,則
Cr2O72-~6Fe2+~12mol電子,1mol Cr2O72-完全生成Cr(0H)3沉淀,外電路通過電子的物質的量為12mol,
故答案為:12;
②溶液的pH=6,則c(OH-)=10-8mol•L-1,則c3(OH-)×c(Cr3+)=Ksp=10-32,c(Cr3+)=10-8mol•L-1<10-5mol•L-1,能直接排放,
故答案為:能;
(3)①加入一定量 Na2S2O3 溶液,發生反應為:2S2O32-+I2═S4O62-+2I-,使I2還原為I-,故藍色會消失,故答案為:藍色消失,半分鐘內不變色;
②由圖示表明,pH至1~3時,ClO2-將I-氧化生成的I2,ClO2-中氯的化合價由+3價降低到-1價,一個ClO2-得到4個電子,碘的化合價由-1價升高到0價,一個I-失去1個電子,轉移電子的最小公倍數為4,結合質量守恒、電荷守恒可知離子方程式為:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
故答案為:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
③ClO2 ~I-~S2O32-
1 1
1.0×10-5mol 1.0×10-3 mol/L×0.01L
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水樣的體積為1.0L,所以 ClO2 的濃度為$\frac{0.675mg}{1L}$=0.675 mg•L-1,
故答案為:0.675.
點評 本題主要考查了氧化還原反應、離子方程式式的書寫以及化學計算,難度中等,注意掌握實驗原理和電子得失配平的方法.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCl2與足量的鐵粉反應,反應轉移電子的數目為3NA | |
| B. | 室溫時,足量Zn與濃硫酸反應共產生2mol氣體,轉移電子數為4NA | |
| C. | 7.8gNa2O2與足量水反應時轉移電子數目為0.2NA | |
| D. | 1mol二氧化氮氣體久置后在標準狀況下的體積為22.4L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50mL18.4mol/L濃硫酸與足量銅微熱反應,生成SO2分子的數目為0.46NA | |
| B. | 某密閉容器盛有0.1mol N2和0.3mol H2,在一定條件下充分反應,轉移電子的數目為0 6NA | |
| C. | 若由CO2和O2組成的混合物中共有NA個分子,則其中的氧原子數為2 NA | |
| D. | 常溫下,1L 0. 1 mol/L NH4NO3溶液中的氫原子數為0.4 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y | |
| B. | 工業上通過電解Y的無水鹽來制備Y的單質 | |
| C. | 最高價氧化物對應水化物的酸性:W>Z>X | |
| D. | 氧元素分別與X、Y、Z、W形成的化合物都不止一種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①③④ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com