
| n |
| V |
| 0.01mol |
| 0.1L |


科目:高中化學 來源: 題型:
| A、人體缺碘,可通過食用加碘鹽補碘 |
| B、染發劑有植物染發劑、無機染發劑、合成染發劑等 |
| C、若不慎接觸敵敵畏或甲胺磷,最好用中性皂液清洗 |
| D、缺鐵性貧血,可通過食用鐵強化醬油預防 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 電離平衡常數 (25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |
| A. | HNO2+HS-═NO2-+H2S↑ |
| B. | 2HCOOH+SO32-═2HCOO-+H2O+SO2↑ |
| C. | H2SO3+2HCOO-═2HCOOH+SO32- |
| D. | H2SO3+SO32-═2HSO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

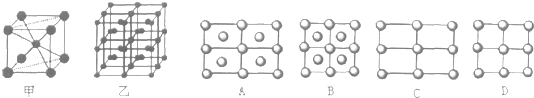
查看答案和解析>>
科目:高中化學 來源: 題型:
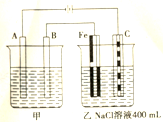 下圖為相互串聯的甲乙兩個電解池,試回答:
下圖為相互串聯的甲乙兩個電解池,試回答:查看答案和解析>>
科目:高中化學 來源: 題型:
| 壓強MPa 氨的平均含量(%) 溫度(攝氏度) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:
| 酸或堿 | 電離常數(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com