
某溫度下,飽和石灰水的溶解度為Sg,密度為ρg/mL,向足量該飽和溶液中加入mgCaO,充分作用后,恢復到原來溫度,下列有關說法不正確的是( )
A.最終得到沉淀的質量大于 37m/28g
B.該飽和溶液質量百分比濃度為 s/(100+s)%
C.最終所得溶液PH不變
D.該飽和溶液中溶質物質的量濃度為
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016年陜西西藏民族學院附屬中學高二上期末化學卷(解析版) 題型:填空題
已知某氣體反應的平衡常數可表示為K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,該反應在不同溫度下的平衡常數:400℃,K=32;500℃,K=44.
請回答下列問題:
(1)寫出上述反應的化學方程式 .
(2)該反應的正反應是 反應(填“放熱”或者“吸熱”)
(3)已知在密閉容器中,測得某時刻各組分的濃度如下:

①此時系統溫度400℃,比較正、逆反應速率的大小:v正 v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量為縱坐標,以溫度為橫坐標,此時反應點在圖象的位置是圖中 點.比較圖中B、D兩點所對應的正反應速率B D(填“>”、“<”或 “=”).理由是 .
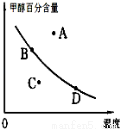
(4)一定條件下要提高反應物的轉化率,可以采用的措施是
a.升高溫度 b.加入催化劑
c.壓縮容器的體積 d.增加水蒸氣的濃度
e.及時分離出產物.
查看答案和解析>>
科目:高中化學 來源:2016屆甘肅省高三上學期第四次月考理綜化學試卷(解析版) 題型:選擇題
下列物質中均含有酸性雜質,除去這些雜質的方法中正確的是
A.乙醇中含乙酸雜質:加入足量氧化鈣,蒸餾
B.制氯氣時,依次通過飽和NaHCO3溶液和濃硫酸凈化氣體
C.CO2中混有H2S通過足量的濃硫酸溶液洗氣,以得到純凈的CO2
D.通過灼熱的鎂粉除去N2中的O2
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏中衛一中高三上學期期末理綜化學試卷(解析版) 題型:推斷題
[化學—有機化學基礎] (15分)
阿斯巴甜作為強烈甜味劑被廣泛應用于食品、飲料、糖果等,工業上可以用苯丙氨酸甲酯和α-氨基丁二酸為原料合成:
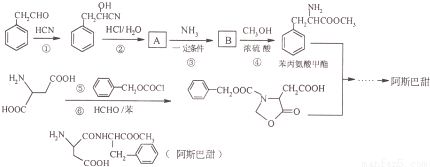
已知:RCN RCOOH;
RCOOH; 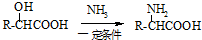
(1)A中含氧官能團的名稱為_________________________ ;
(2)①、⑤的反應類型依次為___________、______________;
(3)B的同分異構體中同時符合下列條件的有2種,寫出其結構簡式______________;
①有三種化學環境不同的氫原子;②含苯環的中性物質
(4)寫出阿斯巴甜與足量NaOH水溶液充分反應的化學方程式_________________________;
(5)寫出以1,3-丙二醇(HOCH2-CH2-CH2OH)為原料制備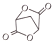 的合成路線流程(無機試劑任選).合成路線流程示例如下
的合成路線流程(無機試劑任選).合成路線流程示例如下 :
:
_______________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2016屆山西省高三上12月月考化學試卷(解析版) 題型:選擇題
如圖是第三周期11~17號元素某些性質變化趨勢的柱形圖,下列有關說法中正確的是( )
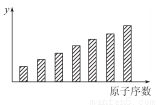
A.y軸表示的可能是基態的原子失去一個電子所需要的最小能量;
B.y軸表示的可能是原子在化合物中吸引電子的能力標度;
C.y軸表示的可能是原子半徑;
D.y軸表示的可能是形成基態離子轉移的電子數
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅省高二上期末考試化學試卷(解析版) 題型:簡答題
有可逆反應Fe(s)+CO2(g)  FeO(s) + CO(g),已知在溫度938K時,平衡常數K=1.5,在1173K時,K=2.2 。
FeO(s) + CO(g),已知在溫度938K時,平衡常數K=1.5,在1173K時,K=2.2 。
(1)能判斷該反應達到平衡狀態的依據是 (雙選,填序號)。
A.容器內壓強不變了 B.c(CO)不變了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)該反應的正反應是_____________(選填“吸熱”、“放熱”)反應。
(3)寫出該反應的平衡常數表達式______________。若起始時把Fe和CO2放入體積固定的密閉容器中,CO2的起始濃度為2.0mol/L,某溫度時達到平衡,此時容器中CO的濃度為1.0 mol/L,則該溫度下上述反應的平衡常數K=______________(保留二位有效數字)。
(4)若該反應在體積固定的密閉容器中進行,在一定條件下達到平衡狀態,如果改變下列條件,反應混合氣體中CO2的物質的量分數如何變化(選填“增大”、“減小”、“不變”)。

①升高溫度________________;②再通入CO_________________。
(5)該反應的逆反應速率隨時間變化的關系如圖:
①從圖中看到,反應在t2時達平衡, 在t1時改變了某種條件,改變的條件可能是(填序號)
__ ___。(單選)
A.升溫 B.增大CO2濃度
②如果在t3時從混合物中分離出部分CO,t4~ t5時間段反應處于新平衡狀態,請在圖上畫出t3~ t5的V(逆)變化曲線
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅省高一上期末考試化學試卷(解析版) 題型:選擇題
鑒別NaCl、NaBr、NaI可以采用的試劑是( )
A.碘水、淀粉溶液 B.碘化鉀淀粉溶液 C.溴水、苯 D.氯水、CCl4
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江省高一上期末化學試卷(解析版) 題型:填空題
(1)KClO3與濃鹽酸發生反應:KClO3+6HCl(濃)= KCl+3Cl2↑+3H2O,該反應中被氧化的元素和被還原的元素的質量之比為__________。轉移1 mol電子時,產生標準狀況下的Cl2__________ L。
(2)與Cl2相比較,ClO2處理水時被還原成Cl-,不生成有機氯代物等有害物質。工業上用亞氯酸鈉和稀鹽酸為原料制備ClO2反應: NaClO2+HCl→ClO2↑+NaCl+H2O
寫出配平的化學方程式________________。生成0.2 mol ClO2轉移電子的物質的量為________ mol。
(3)取體積相同的KI、Na2SO3、FeBr2溶液,分別通入足量氯氣,當恰好完全反應時,三種溶液消耗氯氣的物質的量相同,則KI、Na2SO3、FeBr2溶液的物質的量濃度之比為__________________。如果向FeBr2 溶液中通入等物質的量的Cl2,該反應的離子方程式為___________________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高一上學期12月月考化學試卷(解析版) 題型:填空題
工業電解飽和食鹽水模擬裝置的結構如圖所示:
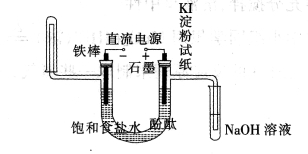
(1)寫出電解飽和食鹽水的化學方程式 ,該工業稱為 工業
(2)實際生產中使用的鹽往往含有一些雜質,在電解食鹽水之前,需要提純食鹽水。為了除去粗鹽中的Ca2+、Mg2+、SO42-及泥沙,可將粗鹽溶于水,然后進行下列五項操作,正確的操作順序是
①過濾 ②加過量的NaOH溶液 ③加適量的鹽酸 ④加過量的Na2CO3溶液 ⑤加過量的BaCl2溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④③①
(3)在該裝置中寫出裝NaOH溶液試管中所發生的化學反應方程式(并用雙線橋表示電子的轉移的方向和數目) 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com