
 氫能被視為21世紀最具發展潛力的清潔能源.
氫能被視為21世紀最具發展潛力的清潔能源.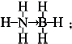 ;與氨硼烷互為等電子體的有機小分子是CH3CH3(寫結構簡式).
;與氨硼烷互為等電子體的有機小分子是CH3CH3(寫結構簡式).分析 (1)a.H2O中H、O元素形成的極性鍵,分子空間結構呈V型,正負電荷中心不重合,屬于極性分子;
b.H2O分子中2個氫原子的2個由s軌道與氧原子的sp3雜化軌道形成σ鍵;
c.水分子之間是通過氫鍵作用形成冰晶體;
d.冰晶胞: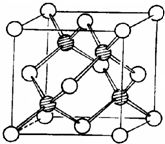 ,干冰晶胞:
,干冰晶胞: ;
;
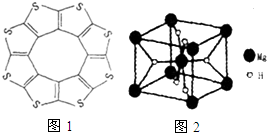
(2)①對于有機物利用雜化軌道數=孤對電子對數+σ鍵數進行判斷,當n=2,sp雜化,n=3,sp2雜化,n=4,sp3雜化;分子中的C與S原子之間有π鍵或分子中的碳硫鍵具有一定程度的雙鍵性質;分子與分子間的作用力為分子間作用力;
②根據氮原子提供一對共用電子對給硼原子形成配位鍵;根據等電子體具有相同的電子數目和原子數目來分析;
③CaF2的結構如圖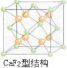 ,利用均攤法計算;
,利用均攤法計算;
④先根據均攤法確定該晶胞中含有的各種原子個數,從而得出其質量,再根據V=$\frac{m}{ρ}$計算其體積.
解答 解:(1)a.H2O分子空間結構呈V型,正負電荷中心不重合,屬于極性分子,故a錯誤;
b.H2O分子中2個氫原子的2個由s軌道與氧原子的sp3雜化軌道形成σ鍵,故b正確;
c.水形成冰晶體是通過氫鍵作用的,不是H-O鍵,故c錯誤;
d.冰晶胞: ,干冰晶胞:
,干冰晶胞: ,即冰晶胞中水分子的空間排列方式與干冰胞不同,故d錯誤;
,即冰晶胞中水分子的空間排列方式與干冰胞不同,故d錯誤;
故答案為:b;
(2)①根據圖2結構可知:碳原子形成2個C-S,1個C=S二鍵,C原子雜化軌道數為(2+1)=3,C原子采取sp2雜化方式;
分子中的C與S原子之間有π鍵或分子中的碳硫鍵具有一定程度的雙鍵性質,可導致C16S8中碳硫鍵鍵長介于C-S與C=S之間;
分子之間存在范德華力,C16S8與H2微粒間的作用力是范德華力,
故答案為:sp2;分子中的C與S原子之間有π鍵或分子中的碳硫鍵具有一定程度的雙鍵性質;范德華力;
②氮原子提供一對共用電子對給硼原子形成配位鍵,氨硼烷的結構式為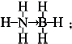 ,等電子體具有相同的電子數目和原子數目,與氨硼烷互為等電子體的有機小分子是CH3CH3,
,等電子體具有相同的電子數目和原子數目,與氨硼烷互為等電子體的有機小分子是CH3CH3,
故答案為: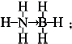 ;CH3CH3;
;CH3CH3;
③CaF2的結構如圖 ,根據題意知,該晶胞中銅原子個數=6×$\frac{1}{2}$=3,金原子個數=8×$\frac{1}{8}$=1,氫原子可進入到由Cu原子與Au原子構成的四面體空隙中,則H原子應位于晶胞內部,氫原子相當于該晶胞中的F離子,所以該晶胞中應含有8個H,所以其化學式為Cu3AuH8,
,根據題意知,該晶胞中銅原子個數=6×$\frac{1}{2}$=3,金原子個數=8×$\frac{1}{8}$=1,氫原子可進入到由Cu原子與Au原子構成的四面體空隙中,則H原子應位于晶胞內部,氫原子相當于該晶胞中的F離子,所以該晶胞中應含有8個H,所以其化學式為Cu3AuH8,
故答案為:Cu3AuH8;
④該晶胞中鎂原子個數=$\frac{1}{8}$×8+1=2,氫原子個數=4×$\frac{1}{2}$+2=4,V=$\frac{m}{ρ}$=$\frac{\frac{M}{{N}_{A}}(24×2+1×4)}{ρ}$cm3=$\frac{52}{a•{N}_{A}}$ cm3,
故答案為:$\frac{52}{a•{N}_{A}}$.
點評 本題考查物質結構和性質,涉及雜化方式的判斷、空間構型的判斷、晶胞的計算等知識點,難點是晶胞的計算,靈活運用公式是解本題關鍵,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 含有-OH的有機化合物性質相同 | |
| B. | 鍋爐水垢中的CaSO4可用飽和Na2CO3溶液處理,使之轉化為CaCO3后再用鹽酸除去 | |
| C. | 鈉的金屬性比鉀強,工業上用鈉制取鉀(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有單質參加,又有單質生成的反應一定是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂燃燒發出耀眼的白光,可用來制造信號彈和焰火 | |
| B. | 碳酸氫鈉能與酸反應,可用來治療胃酸過多 | |
| C. | 利用銅與氯化鐵溶液的反應來制作印刷電路板 | |
| D. | 鋁制品表面有致密的氧化膜保護層,可長時間盛放咸菜等腌制食品 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 酸性溶液中KIO3與KI反應生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬氧化物一定是堿性氧化物,非金屬氧化物不一定是酸性氧化物 | |
| B. | 有單質參加或生成的化學反應一定是氧化還原反應 | |
| C. | 金屬陽離子被還原一定得到相應的金屬單質 | |
| D. | 在氧化還原反應中金屬單質只能作還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
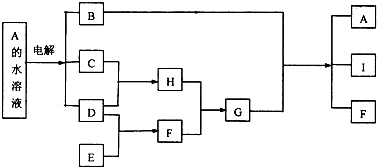
 某課外活動小組同學用如圖裝置進行實驗,一段時間后在C電極表面有銅析出,試回答下列問題.
某課外活動小組同學用如圖裝置進行實驗,一段時間后在C電極表面有銅析出,試回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,說明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$無現象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+說明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成紅褐色沉淀,說明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成無色氣體,說明原溶液中含有CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com