
【題目】氟碳鈰礦的主要化學成分為CeFCO3,它是提取鈰族稀土元素的重要礦物原料,二氧化鈰(CeO2) 是一種重要的稀土氧化物。以氟碳鈰礦為原料制備CeO2的一種工藝流程如下:
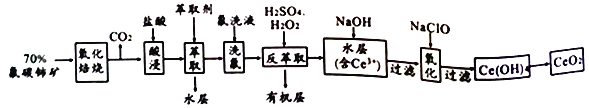
已知:①Ce 4+既能與F 結合成[CeFx](4-x)+,也能與SO42-結合成[CeSO4]2+;
②在硫酸體系中Ce4+ 能被萃取劑[(HA)2]萃取,而Ce3+不能。
回答下列問題:
(1) “氧化焙燒”的目的是______________。
(2)“酸浸”中會產生大量黃綠色氣體、請寫出CeO2與鹽酸反應的離子方程式___________________;為避免產生上述污染,請提出一種解決方案________________________。
(3)“萃取”時存在反應:Ce4++n(HA)2![]() Ce+(H2a-4A2a)+4H+。實驗室中萃取時用到的主要玻璃儀器為______________;若缺少 “洗氟”,則所得產品的質量將_________(填“偏大”、“偏小”或 “不變”)。
Ce+(H2a-4A2a)+4H+。實驗室中萃取時用到的主要玻璃儀器為______________;若缺少 “洗氟”,則所得產品的質量將_________(填“偏大”、“偏小”或 “不變”)。
(4) “反萃取”中,加稀硫酸和H2O2的作用__________________(用離子方程式表示)。
(5)取上述流程中得到的CeO2產品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4標準溶液滴定至終點時(鈰被還原為Ce3+,其它雜質均不參加反應)消25.00mL標準溶液,該產品中CeO2的質量分數為________。
【答案】 將+3價鈰氧化成+4價(將CeFCO3氧化成CeO2) 2CeO2+8H++2Cl-=2Ce3++Cl2↑+4H2O 改用H2SO4酸浸 分液漏斗 偏小 Ce4++H2O2=2Ce3++O2↑+2H+ 86.0%或0.86
【解析】試題分析:(1)“氧化焙燒”可以將將+3價鈰氧化成+4價;(2)“酸浸”中鹽酸被CeO2氧化為黃綠色氯氣,CeO2被還原為Ce3+;為避免氧化還原反應發生,可以改用硫酸;(3)“萃取”時要分液;根據Ce4+能與F-結合成[CeFx](4-x)+分析;(4)在硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能,“反萃取”中,加稀硫酸和H2O2可以將Ce4+還原為Ce3+;(5)根據電子守恒FeSO4與CeO2的關系式是FeSO4![]() CeO2,利用關系式計算。
CeO2,利用關系式計算。
解析:(1)“氧化焙燒”可以將CeFCO3中+3價鈰氧化成CeO2中+4價鈰;(2)“酸浸”中鹽酸被CeO2氧化為黃綠色氯氣,CeO2被還原為Ce3+,離子方程式是2CeO2+8H++2Cl-=2Ce3++Cl2↑+4H2O ;為避免氧化還原反應發生,可以改用H2SO4酸浸;(3)“萃取”時要分液,用到的主要玻璃儀器是分液漏斗;Ce4+能與F-結合成[CeFx](4-x)+,若缺少“洗氟”,則所得產品的質量將偏小;(4)在硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能,“反萃取”中,加稀硫酸和H2O2可以將Ce4+還原為Ce3+,反應離子方程式是Ce4++H2O2=2Ce3++O2↑+2H+;
(5)設CeO2的質量是xg
FeSO4 ![]() CeO2 ,
CeO2 ,
1mol 172g
0.025L![]() 0.1mol·L-1 xg
0.1mol·L-1 xg
![]()
X=0.43g;該產品中CeO2的質量分數為![]() 。
。


科目:高中化學 來源: 題型:
【題目】宇宙飛船上常使用氫氧燃料電池,其電極總反應式為:2H2+O2=2H2O;若電解質溶液為KOH溶液,則下列敘述正確的是:
A. 此電池能見到淺藍色火焰 B. H2為正極,O2為負極
C. 工作時電解液中OH-的物質的量不斷增加 D. 電極反應中: H2失電子; O2得電子
【答案】D
【解析】A.該電池中氫氣不燃燒,所以不能見到淺藍色火焰,A錯誤;B.該原電池中,負極上通入氫氣,正極上通入氧氣,B錯誤;C.電池反應式為:2H2+O2=2H2O,根據方程式知,電解質溶液中氫氧根離子的物質的量不變,C錯誤;D.負極上電極反應式為:2H2+4OH--4e-=4H2O,正極上電極反應式為:O2+2H2O+4e-=4OH-,所以負極上氫氣失電子,正極上氧氣得電子,D正確;答案選D。
點睛:本題考查燃料電池,明確正負極上得失電子是解本題關鍵,難點是電極反應式的書寫,電極反應式的書寫要結合電解質溶液的酸堿性,有時還需要考慮交換膜以及是不是熔融的電解質等。
【題型】單選題
【結束】
21
【題目】可逆反應aA(g)+bB(s)cC(g)+dD(g),其他條件不變,C的物質的量分數和溫度(T)或壓強(P)關系如圖,其中正確的是 ( )
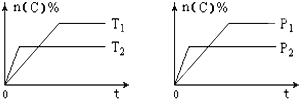
A. P1 > P2
B. 該反應的ΔH < 0
C. 化學方程式系數a>c+d
D. 使用催化劑,C的物質的量分數增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填寫下列相關內容:
(1)在常溫下,將體積為 VaL、pH 為 a 的稀硫酸和體積為 VbL、pH為 b 的燒堿溶液混合,若所得混合液為中性。如果 a+b=15,則 Va:Vb=_______。某溫度時,水的離子積常數 Kw=1×10-13.在此溫度下,將 pH=a 的硫酸溶液 VaL與 pH=b的 NaOH 溶液 VbL 混合,若所得混合液為中性,如果 a+b=12,則 Va:Vb=_______。
(2)中和相同體積,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三種稀溶液所用相同濃度的鹽酸的體積分別為 V1、V2、V3,則三種關系為______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)常溫下將 0.2mol/LHCl 溶液與 0.2mol/LMOH 溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的 pH=6,試回答以下問題:
①0.2mol/LHCl 溶液中由水電離出的 c(H+)______0.2mol/LMOH 溶液中由水電離出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精確計算結果(填具體數字):c(Cl-)-c(M+)=_______mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 現將 CaCl2 溶液與 0.02 mol·L-1Na2CO3 溶液等體積混合,生成 CaCO3 沉淀時,所需 CaCl2 溶液的最小物質的量濃度為______mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組微粒半徑由小到大的排列順序正確的是( )
A.Na<Si<PB.O2->Mg2+>Al3+
C.Ca>Ba>Ca2+D.Cl->F>F-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組設計如圖所示的微型實驗裝置。實驗時,現斷開K2,閉合K1,兩極均有氣泡產生;一段時間后,斷開K1,閉合K2,發現電流表指針偏轉,下列有關描述正確的是

A. 斷開K2,閉合K1時,總反應的離子方程式為:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 斷開K2,閉合K1時,石墨電極附近溶液變紅
C. 斷開K1,閉合K2時,銅電極上的電極反應為: Cl2+2e-=2Cl-
D. 斷開K1,閉合K2時,石墨電極作正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,下列敘述不能作為可逆反應A(g)+3B(g)![]() 2C(g)達到平衡標志的是
2C(g)達到平衡標志的是
①C的生成速率與C的消耗速率相等
②單位時間內生成a mol A,同時生成3a mol B
③A、B、C的濃度不再變化
④C的物質的量不再變化
⑤混合氣體的總壓強不再變化
⑥混合氣體的總物質的量不再變化
⑦單位時間消耗a molA,同時生成3a mol B
⑧A、B、C的分子數之比為1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知a、b、c、d、e、f都是周期表中前四周期的元素,它們的原子序數依次增大。其中a、c原子的L層有2個未成對電子,d與e同主族,d的二價陽離子與c的陰離子具有相同的電子層結構,f3+離子M層3d軌道電子為半充滿狀態。請根據以上信息,回答下列問題(答題時,用所對應的元素符號表示):
(1)畫出f3+離子的價層電子排布圖__________,bH3分子中b原子的價層電子對構型為__________。
(2)寫出一種與ab-互為等電子體的分子的化學式_________,ab-中a原子的雜化方式為_______。
(3)f和m(質子數為25) 兩元素的部分電離能數據列于下表:
元素 | m | f | |
電能(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比較兩元素的I2、I3可知,氣態m2+再失去一個電子比氣態f2+再失去一個電子難,原因是____________。
(4)已知e的碳酸正鹽熱分解溫度比d的高,其原因是___________________。
(5)已知CaF2晶體常用于助熔劑,其晶胞結構如圖所示。
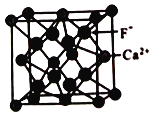
設阿伏加德羅常數的值為NA ,F原子和Ca原子之間的距離為apm,在晶胞體對角線的1/4、3/4兩點分別有個F-,則Ca2+的配位數是_______,晶體的密度為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下的密閉容器中,反應2SO2(g)+O2(g)![]() 2SO3(g)達到平衡。縮小容器容積,對反應產生影響的敘述不正確的是
2SO3(g)達到平衡。縮小容器容積,對反應產生影響的敘述不正確的是
A. 使SO3的濃度增大 B. 使平衡向正反應方向移動
C. 使平衡常數K增大 D. 使正反應速率大于逆反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中有關微粒的物質的量濃度關系正確的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水電離的c(OH-)相等
B. 常溫下將醋酸鈉、鹽酸兩溶液混合后,溶液呈中性,則混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常溫下物質的量濃度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三種溶液中NH4+的濃度:②>③>①>④
D. 等體積等物質的量濃度的NaClO(aq)與NaCl(aq)中離子總數:N前>N后
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com