
| 元素代號 | L | M | Q | R | T |
| 原子半徑/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.075 |
| 主要化合價 | +2 | +3 | +2 | +6,-2 | -2 |
| A. | 氫化物的沸點為H2T<H2R,金屬性L>Q | |
| B. | M與T形成的化合物具有兩性 | |
| C. | L2+與R2-的核外電子數相等 | |
| D. | L的原子半徑最大,電負性最小,T的原子半徑最小,電負性最大 |
分析 短周期元素,T、R都有-2價,處于ⅥA族,T只有-2價,則T為O元素、R為S元素,L、Q都有+2價,處于ⅡA族,原子半徑L>Q,則L為Mg元素、Q為Be元素,M有+3價,處于ⅢA族,原子半徑M的介于L、R之間,則M為Al元素.
解答 解:短周期元素,T、R都有-2價,處于ⅥA族,T只有-2價,則T為O元素、R為S元素,L、Q都有+2價,處于ⅡA族,原子半徑L>Q,則L為Mg元素、Q為Be元素,M有+3價,處于ⅢA族,原子半徑M的介于L、R之間,則M為Al元素.
A.同主族自上而下金屬性增強,金屬性Mg>Be,水分子之間存在氫鍵,沸點H2O>H2S,故A錯誤;
B.M與T形成的化合物是氧化鋁,屬于兩性氧化物,故B正確;
C.L2+的核外電子數為12-2=10,R2-的核外電子數為16-(-2)=18,不相等,故C錯誤;
D.同周期自左而右原子半徑減小、同主族自上而下原子半徑增大,故原子半徑Mg>O,非金屬性越強,電負性越大,故電負性Mg<O,故D正確,
故選BD.
點評 本題考查結構性質位置關系應用,利用原子半徑及化合價來推斷出元素是解答本題的關鍵,注意對元素周期律的理解掌握,難度不大.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
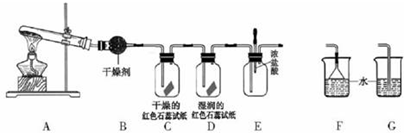
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下,22.0g C18O2氣體中含有的碳原子數目為0.5NA | |
| B. | 1mol OH-中電子數為10NA | |
| C. | 標準狀況下,22.4L乙醇中含有的氧原子數為1.0NA | |
| D. | 1mol C2Cl6分子含有7 NA個共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用催化氫化法除去甲烷中的少量乙烯 | |
| B. | 苯與液溴反應,苯與H2反應屬于同一類型的反應 | |
| C. | 苯不能使KMnO4溶液褪色,所以苯不能發生氧化反應 | |
| D. | 丙炔可以發生取代反應,加成反應、加聚反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應體系的總壓恒定 | B. | A、B、C、D的物質的量之比為1:3:2:2 | ||
| C. | c(A):c(B)=1:3 | D. | 2V(B)正=3V(C)逆 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| X | Y | |
| Z | W |
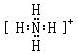 ,Y的氣態氫化物的穩定性比Z的氣態氫化物的穩定性強(填“強”、或“弱”).
,Y的氣態氫化物的穩定性比Z的氣態氫化物的穩定性強(填“強”、或“弱”).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵(26Fe)是地球上分布最廣的金屬之一,約占地殼質量的5.1%,居元素分布序列中的第四位,僅次于O、Si和Al.請結合所學知識回答下列問題:
鐵(26Fe)是地球上分布最廣的金屬之一,約占地殼質量的5.1%,居元素分布序列中的第四位,僅次于O、Si和Al.請結合所學知識回答下列問題: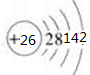
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com