
| A. | CO→CO2 | B. | FeCl2 →FeCl3 | C. | Na2SO3 →SO2 | D. | CuO→Cu |
 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.40mol/L | B. | 0.30mol/L | C. | 0.075mol/L | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 應稱量NaOH的質量/g | 應選用容量瓶的規格/mL | 除容量瓶外還需要的其它儀器 |
| 4.0 | 500 | 燒杯、量筒、玻璃棒、藥匙、托盤天平、膠頭滴管 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 失去電子的反應是還原反應 | |
| B. | 在氧化還原反應中不一定所有的元素的化合價都發生變化 | |
| C. | 做氧化劑的物質不能是還原劑 | |
| D. | 發生還原反應的元素對應產物是氧化產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵和硫酸銅溶液反應得到銅 | |
| B. | 鐵和稀鹽酸反應生成H2和FeCl2 | |
| C. | 鐵高溫下和水蒸氣反應生成H2和Fe2O3 | |
| D. | 鐵在氧氣中燃燒生成Fe3O4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
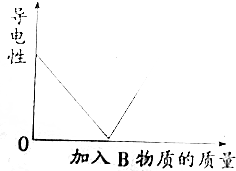 向某A溶液中加入一種物質B,其導電能力變化與加入B物質的質量關系符合如圖曲線的是( )
向某A溶液中加入一種物質B,其導電能力變化與加入B物質的質量關系符合如圖曲線的是( )| A. | 鹽酸中滴加Ba(OH)2溶液至過量 | |
| B. | CaCl2溶液中滴加濃Na2CO3溶液至過量 | |
| C. | AgNO3溶液中滴加NaCl溶液至過量 | |
| D. | 稀硫酸中滴加Ba(OH)2溶液至過量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
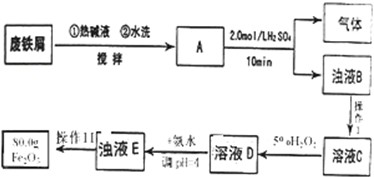
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com