
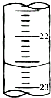
 某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:
某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:| 滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 (1)根據溶液顏色變化且30S內不變色,可說明達到滴定終點;
(2)實驗中應控制流速并觀察錐形瓶中顏色變化;
(3)根據待測溶液潤洗錐形瓶,會使的待測液的物質的量增多;根據c(待測)=$\frac{c(標注)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷;
(4)根據酸式滴定管用蒸餾水洗凈后,應用標準鹽酸潤洗;
(5)讀數時目光平視,凹液面最低點與刻度線相切;
(6)先判斷數據的合理性,然后鹽酸溶液的平均體積,然后根據HCl~NaOH求NaOH溶液的物質的量濃度;
解答 解:(1)標準酸滴定NaOH溶液,以酚酞作指示劑,滴定終點時,溶液的顏色由紅色變為無色,并且30S內不變色;
故答案為:紅;無;
(2)滴定時邊滴邊搖動錐形瓶,眼睛應觀察錐形瓶中顏色變化,以判定終點;
故答案為:B;
(3)根據待測溶液潤洗錐形瓶,會使的待測液的物質的量增多,造成V(標準)偏大,根據根據c(待測)=$\frac{c(標注)×V(標準)}{V(待測)}$分析,可知c(待測)偏大;
故答案為:待測溶液潤洗錐形瓶;偏高;
(4)根據酸式滴定管用蒸餾水洗凈后,應用標準鹽酸潤洗,以防被稀釋;
故答案為:用標準液潤洗滴定管;
(5)待測液的物質的量不變,讀數時目光平視,凹液面最低點與刻度線相切,所以讀數為22.60mL;
故答案為:22.60;
(6)兩次消耗的鹽酸標準液的體積為19.90mL,20.00mL,均有效,標準鹽酸溶液的平均體積為19.95mL,
HCl~NaOH
1 1
0.1000mol•L-1×19.95mL c(NaOH)×25.00mL
解得:c(NaOH)=0.08mol/L;
故答案為:0.08.
點評 本題主要考查了酸堿中和滴定的操作、誤差分析以及有關的化學計算,難度中等,掌握中和滴定的原理是解題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 硫化亞鐵溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法處理汽車尾氣中的CO和NO:CO+NO$\stackrel{催化劑}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
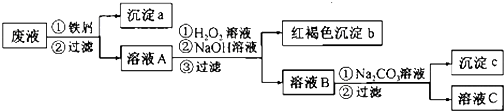
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
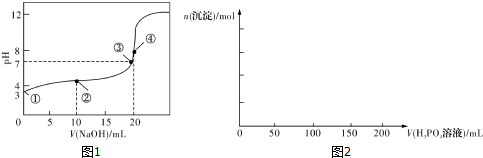
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 學生用0.1mol/L KOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
學生用0.1mol/L KOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:| 滴定次數 | 待測溶液的體積/mL | 標準溶液的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金剛石>晶體硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
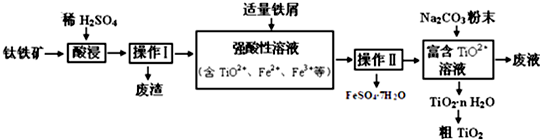
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com