
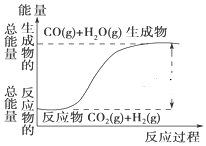
| A. | 其熱化學方程式為:CO(g)+H2O(g)=CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 該反應為吸熱反應 | |
| C. | 該反應為放熱反應 | |
| D. | 當H2O為液態時,其反應熱值大于41kJ•mol-1. |
分析 由圖可知反應物能量小于生成物,正反應吸熱,熱化學方程式為:CO2(g)+H2(g)=CO(g)+H2O(g)△H=41kJ•mol-1,水由氣態變為液態放熱,以此解答該題.
解答 解:A.該反應熱化學方程式為:CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41kJ•mol-1,故A錯誤;
B.反應物能量小于生成物,正反應吸熱,故B正確;
C.由B分析可知正反應吸熱,故C錯誤;
D.水由氣態變為液態放熱,所以該反應吸熱減少,其反應熱的值小于41kJ•mol-1,故D錯誤.
故選B.
點評 本題考查化學反應中的能量變化,為高頻考點,側重于學生的分析能力的考查,題目難度不大,注重基礎知識的考查.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
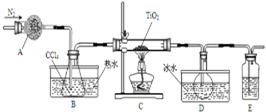 實驗室利用反應TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在無水無氧條件下制備TiCl4,實驗裝置示意圖如下,有關物質性質如表.
實驗室利用反應TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在無水無氧條件下制備TiCl4,實驗裝置示意圖如下,有關物質性質如表.| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產白霧 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若單位時間內生成的B和D的物質的量之比為3:1,則體系處于平衡狀態 | |
| B. | C的平衡濃度為1mol/L | |
| C. | 5min內B的平均消耗速率為0.3mol/(L•min) | |
| D. | 平衡后,增大壓強,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石墨不如金剛石穩定 | |
| B. | 金剛石不如石墨穩定 | |
| C. | 金剛石和石墨的轉化是物理變化 | |
| D. | C(s,金剛石)═C(s,石墨)△H=-1.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | Si-O | O=O | Si-Si |
| 鍵能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH- | ||
| C. | KClO3=K++ClO3- | D. | MgSO4═Mg+2+SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com