
【題目】(1)已知可逆反應:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,請回答下列問題:
P(g)+Q(g) ΔH>0,請回答下列問題:
①在某溫度下,反應物的起始濃度分別為c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;達到平衡后,M的轉化率為60%,此時N的轉化率為________。
②若反應溫度升高,M的轉化率________(填“增大”、“減小”或“不變”)。
③若反應溫度不變,反應物的起始濃度分別為c(M)=4 mol·L-1,c(N)=a mol·L-1;達到平衡后,c(P)=2 mol·L-1,a=________。
④若反應溫度不變,反應物的起始濃度為c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此時v(正)_____v(逆)(填“>”、“<”或“=”)
(2)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,據此回答以下問題:
2NH3(g) ΔH=-92.4 kJ/mol,據此回答以下問題:
①根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越________。
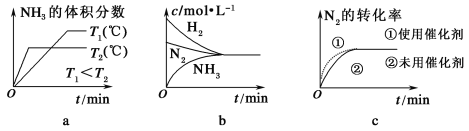
②對于合成氨反應而言,下列有關圖像一定正確的是(選填序號)________。
③相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1 mol N2和3 mol H2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;B中NH3的體積分數為b,放出熱量Q2 kJ。則:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
【答案】25%增大6<小a、c<<<
【解析】
(1)△c(M)=60%×1molL-1=0.6molL-1,濃度變化量之比等于化學計量數之比,所以△c(N)=△c(M)=0.6molL-1,故此時N的轉化率0.6/2.4×100%=25%;綜上所述,本題答案:25%。
(2)該反應正反應為吸熱反應,升高溫度平衡向吸熱方向移動,即向正反應方向移動,M的轉化率增大;綜上所述,本題答案是:增大。
(3))△c(M)=60%×1molL-1=0.6molL-1,則:
M(g)+N(g)P(g)+Q(g);
初始(mol/L): 1 2.4 0 0
轉化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故該溫度下平衡常數k=0.6×0.6/0.4×1.8=0.5;
反應溫度不變,反應物的起始濃度分別為c(M)=4molL-1,c(N)=amolL-1;達到平衡后,c(P)=2molL-1,則:
M(g)+N(g)P(g)+Q(g);
初始(mol/L):4 a 0 0
轉化(mol/L):2 2 2 2
平衡(mol/L):2 a-2 2 2
所以2×2/2×(a-2)=0.5,解得a=6,綜上所述,本題答案:6。
④該反應的濃度商為QC=c(P)c(Q)/c(M)c(N)= 2×2/2×2=1,該溫度下的平衡常數為0.5,QC>k,平衡左移,v(正) <v(逆);綜上所述,本題答案:<。
(2)①該反應為放熱反應,溫度越高,平衡左移,平衡常數的值越小;綜上所述,本題答案是:小。
②a.圖像中曲線先出現拐點的先達到平衡,則T2溫度高;升高溫度,平衡逆向移動,則氨氣的體積分數減小,但反應到達平衡的時間縮短,與圖像一致,故正確;
b.反應到達平衡時,各物質濃度變化量之比等于其計量數之比,氫氣與氨氣濃度變化量之比為3:2,圖像表示錯誤;故錯誤;
c.使用催化劑加快反應速率,縮短反應時間,但不影響平衡移動,氮氣的轉化率不變,符合題意,與圖像一致,故正確;
綜上所述,本題答案:a、c。
③恒容密閉容器A,反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;而恒壓密閉容器B,均充入1 mol N2和3 mol H2,反應發生后總物質的量減少,由Pv=nRT可以知道,相對于A來說,相當于給B加壓,則平衡正向移動,氨氣的體積分數變大,所以a<b;生成的氨氣多,反應向右進行的程度大,所以B中放出的熱量多,則Q1<Q2;熱化學方程式中反應熱為完全反應放出的熱量,而A中不能完全轉化,放出的熱量少,則Q1<92.4;綜上所述,本題答案是: < , < , <。


科目:高中化學 來源: 題型:
【題目】用足量的CO還原8 g鐵的氧化物,把生成的CO2全部通入到過量的澄清石灰水中,得到的沉淀干燥后質量為15g,則此鐵氧化物的化學式是
A. Fe2O3 B. FeO C. Fe3O4 D. Fe3O4和FeO的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下列實驗裝置不能完成相應實驗的是( )

A. 用裝置①測量生成氧氣的化學反應速率
B. 用裝置②比較NaHCO3和Na2CO3的熱穩定性
C. 裝置③中分液漏斗內的液體可順利加入蒸餾燒瓶
D. 裝置④可實現制取CO2實驗中的“即關即止,即開即用”的作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.氫氧燃料電池放電時化學能全部轉化為電能
B.反應4Fe(s)+3O2(g)=2Fe2O3(s)常溫下可自發進行,該反應為放熱反應
C.在酶催化淀粉水解反應中,溫度越高淀粉水解速率越快
D.金屬發生吸氧腐蝕時,被腐蝕的速率和氧氣濃度無關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了證明在實驗室制備得到的Cl2中會混有HCl,甲同學設計了如圖所示的實驗裝置,按要求回答下列問題。
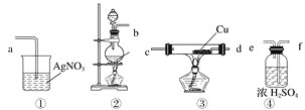
(1)請根據甲同學的示意圖,所需實驗裝置從左至右的連接順序:裝置②→__________。
(2)裝置②中主要玻璃儀器的名稱__________、__________、__________。
(3)實驗室制備Cl2的離子方程式為____________。
(4)裝置③中Cu的作用__________(用化學方程式表示)。
(5)乙同學認為甲同學實驗設計仍然存在缺陷,不能證明最終通入AgNO3溶液中的氣體只有一種。為此,乙同學提出氣體通入裝置①之前,要加裝一個檢驗裝置⑤,以證明最終通入AgNO3溶液中的氣體只有一種。你認為裝置⑤應放入__________。
(6)丙同學看到甲同學設計的裝置后提出無需多加裝置,只需將原來燒杯中的AgNO3溶液換成紫色石蕊試液,如果觀察到__________的現象,則證明制Cl2時有HCl揮發出來。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據反應CuSO4+FeS2+H2O→Cu2S+FeSO4+H2S04判斷1molCuS04能氧化硫的物質的量是
A. 3/11 mol B. 1/7 mol C. 5/7 mol D. 4/7 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據《天工開物》記載,我國古代以爐甘石(主要成分是ZnCO3)來升煉倭鉛(即鋅),其原理如圖。已知鋅的熔點420 ℃、沸點906 ℃。則下列說法不正確的是

A. 升煉倭鉛過程包含分解反應和氧化還原反應
B. 冶煉時鋅變為蒸氣在兜室冷凝為固體
C. “泥封”的目的是為了防止得到的鋅被氧化
D. “鋅火”是鋅蒸氣和一氧化碳在空氣的燃燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】全釩液流電池充電時間短,續航能力強,其充放電原理為VO2++V3++H2O![]() VO2++V2++2H+。以此電池為電源,用石墨電極電解Na2SO3溶液,可得到NaOH和H2SO4示意圖如下。下列說法錯誤的是
VO2++V2++2H+。以此電池為電源,用石墨電極電解Na2SO3溶液,可得到NaOH和H2SO4示意圖如下。下列說法錯誤的是

A. 全釩液流電池放電時,正極的電極反應式為VO2++2H++e-=VO2++H2O
B. 圖中a電極為陰極,N物質是H2
C. 全釩液流電池充電時,V3+被氧化為VO2+
D. 電解時,b電極的反應式為SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C為短周期元素,在周期表中所處的位置如圖所示。A、C兩元素的原子核外電子數之和等于B原子的質子數,B原子核內質子數和中子數相等。
![]()
(1)寫出A、B、C三元素名稱_______、_______、_______。
(2)C在元素周期表中的位置是___________________。
(3)B的原子結構示意圖為______。C的氫化物與B的氫化物的穩定性強弱順序為(填化學式)___________。
(4)比較A、C的原子半徑A____C。寫出A的氣態氫化物與A的最高價氧化物對應水化物反應的化學方程式_____________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com