
【題目】A、B、C為短周期元素,在周期表中所處的位置如圖所示。A、C兩元素的原子核外電子數之和等于B原子的質子數,B原子核內質子數和中子數相等。
![]()
(1)寫出A、B、C三元素名稱_______、_______、_______。
(2)C在元素周期表中的位置是___________________。
(3)B的原子結構示意圖為______。C的氫化物與B的氫化物的穩定性強弱順序為(填化學式)___________。
(4)比較A、C的原子半徑A____C。寫出A的氣態氫化物與A的最高價氧化物對應水化物反應的化學方程式_____________________________________。
【答案】氮硫氟第二周期ⅦA族![]() HF>H2S>NH3+HNO3=NH4NO3
HF>H2S>NH3+HNO3=NH4NO3
【解析】
設B元素的質子數為x,則A的質子數為x-9,C的質子數為x-7,可得x-9+x-7=x,解得x=16,所以A的質子數為7,B的質子數為16,C的質子數為9,分別為N、S、F元素,據此解答。
根據以上分析可知A、B、C三元素分別為N、S、F元素,則
(1)A、B、C三元素的名稱分別是氮、硫、氟;
(2)C元素的原子核內質子數為9,原子核外有2個電子層,最外層電子數為7,位于元素周期表第二周期ⅦA族;
(3)B的原子序數為16,原子核外有3個電子層,最外層電子數為6,原子結構示意圖為![]() ;非金屬性是F>S,非金屬性越強,氫化物越穩定,則C的氫化物與B的氫化物的穩定性強弱順序為HF>H2S;
;非金屬性是F>S,非金屬性越強,氫化物越穩定,則C的氫化物與B的氫化物的穩定性強弱順序為HF>H2S;
(4)元素周期表中,同周期元素從左到右原子半徑逐漸減小,則原子半徑大小關系為N>F;A的氣態氫化物氨氣與A的最高價氧化物對應水化物硝酸反應的化學方程式為NH3+HNO3=NH4NO3。


科目:高中化學 來源: 題型:
【題目】(1)已知可逆反應:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,請回答下列問題:
P(g)+Q(g) ΔH>0,請回答下列問題:
①在某溫度下,反應物的起始濃度分別為c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;達到平衡后,M的轉化率為60%,此時N的轉化率為________。
②若反應溫度升高,M的轉化率________(填“增大”、“減小”或“不變”)。
③若反應溫度不變,反應物的起始濃度分別為c(M)=4 mol·L-1,c(N)=a mol·L-1;達到平衡后,c(P)=2 mol·L-1,a=________。
④若反應溫度不變,反應物的起始濃度為c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此時v(正)_____v(逆)(填“>”、“<”或“=”)
(2)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,據此回答以下問題:
2NH3(g) ΔH=-92.4 kJ/mol,據此回答以下問題:
①根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越________。
②對于合成氨反應而言,下列有關圖像一定正確的是(選填序號)________。
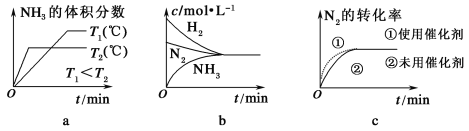
③相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1 mol N2和3 mol H2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;B中NH3的體積分數為b,放出熱量Q2 kJ。則:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在298 K、1.01×105 Pa,將22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反應,測得反應放出的熱量為a kJ。已知該條件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反應放出的熱量為b kJ。則CO2與NaOH反應生成NaHCO3的熱化學方程式為( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰氣的化學式為(CN)2,結構式為N=C—C=N,性質與鹵素相似。下列敘述正確的是( )
A.不和氫氧化鈉溶液發生反應
B.分子中鍵的鍵長大于C≡C鍵的鍵長
C.分子中含有2個σ鍵和4個π鍵
D.分子中既有極性鍵,又有非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型。根據如圖回答下列問題:
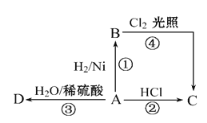
(1)寫出A、B、C、D的結構簡式:A__,B__,C__,D__。
(2)寫出②、④兩步反應的化學方程式,并注明反應類型。
②_________________,反應類型________。
④_________________,反應類型________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于放熱反應Zn+H2SO4=ZnSO4+H2↑,下列敘述正確的是( )

A. 反應過程中的能量關系可用上圖表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若將其設計為原電池,則其能量轉化形式為電能轉化為化學能
D. 若將其設計為原電池,當有32.5gZn溶解時,正極放出的氣體一定為11.2L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應2HI(g)![]() H2(g) +I2(g)的能量變化如圖所示。下列說法正確的是
H2(g) +I2(g)的能量變化如圖所示。下列說法正確的是

A. 常溫下,向體積為VL的容器中充入2mol HI(g)充分反應,可吸收12.5kJ的熱量
B. 加入催化劑,分子的能量不變,但單位體積活化分子數增多,速率加快
C. 其他條件不變,升高溫度,反應速率加快,HI分解率不變
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea為12.5kJ·mol1
2HI(g)的活化能Ea為12.5kJ·mol1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了有香味的酯。在實驗室也可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題。
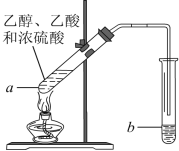
(1)乙醇分子中官能團的名稱是________________。
(2)試管a中加入幾塊碎瓷片的目的是_________。
(3)試管a中發生反應的化學方程式為___________________________________________,反應類型是____________________。
(4)反應開始前,試管b中盛放的溶液是_______________。
(5)可用____________的方法把制得的乙酸乙酯分離出來。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com