
[化學—選修5:有機化學基礎]對乙酰氨基酚,俗稱撲熱息痛(Paracetamol),具有很強的解熱鎮痛作用,工業上通過下列方法合成(圖中B1和B2、C1和C2分別互為同分異構體,無機產物略去):
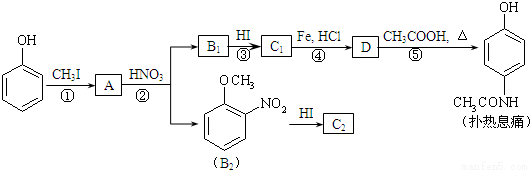
已知: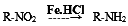 ,請按要求填空:
,請按要求填空:
(1)寫出A分子中官能團名稱:_________;C1的結構簡式為:___________________。
(2)寫出由D生成撲熱息痛的化學方程式:_______________________。
(3)學出反應③和④的反應類型:③______________,④__________。
(4)工業上設計反應①、②、③,而不是只通過反應②得到C1、C2,其目的是:___________。
(5)撲熱息痛有很多同分異構體,符合下列要求的同分異構體有5種:(1)是對位二取代苯;(II)苯環上兩個取代基一個含氮不含碳、另一個含碳不含氮;(III)兩個氧原子與同一原子相連。其中2種的結構簡式是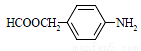 和
和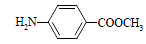 ,寫出另3種同分異構體的結構簡式____________、____________、____________。
,寫出另3種同分異構體的結構簡式____________、____________、____________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:填空題
(1)甲醇(CH3OH)是一種重要的化工原料,廣泛應用于化工生產,也可以直接用做燃料。已知:甲醇的燃燒熱486為kJ·mol-1 ( 2CO (g) + O2(g) = 2CO2(g) △H b =-566.0 kJ·mol-1)
試寫出CH3OH(l)在氧氣中完全燃燒生成CO和H2O(l)的熱化學方程式: 。
(2)常溫下某溶液中由水電離的c(H+)=10-10 mol/L,則該溶液的pH為 _______。
(3)常溫下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定濃度的NaHSO4稀溶液,當溶液中的Ba2+恰好沉淀完全時,溶液pH=11。則Ba(OH)2溶液與NaHSO4溶液的體積比為__________,NaHSO4溶液的物質的量濃度為 。
(4)常溫下,0.5mol/L的NH4Cl溶液的為pH=5.該溶液顯酸性的原因是(用離子方程式表示) 。計算常溫下氨水的電離平衡常數為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省廣安市高一上學期期末化學試卷(解析版) 題型:選擇題
下列各組中的離子,能在無色溶液中大量共存的是
A.H+、 K+、 CO32-、 SO42- B.Fe3+、Na+、NO3-、SO42-
C.Mg2+、Ba2+、OH-、NO3-  D.K+、Mg2+、NO3-、Cl-
D.K+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省高三上摸底考試四化學卷(解析版) 題型:實驗題
辣椒中含辣椒素,局部應用可助減輕疼痛。辣椒素酯類化合物的結構可以表示為: (R為烴基),其中一種辣椒素酯類化合物J的合成路線如下:
(R為烴基),其中一種辣椒素酯類化合物J的合成路線如下:
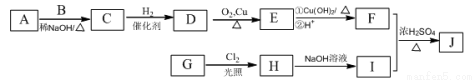
已知:
①A、B和E為同系物,其中B的相對分子質量為44,A和B核磁共振氫譜顯示都有兩組峰,峰面積比分別為9:1和3:1;
②化合物J的分子式為C15H22O4;
③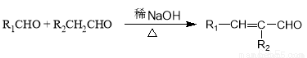
回答下列問題:
(1)G中含有的官能團有 、 。
(2)由C生成D的反應類型為 ,D的化學名稱為 。
(3)①的化學方程式為 。
(4)J的結構簡式為 。
(5)G的同分異構體中,苯環上的一氯代物只有一種的共有 種(不含立體異構),核磁共振氫譜顯示2組峰的是 (寫結構簡式)。
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省高三上摸底考試四化學卷(解析版) 題型:選擇題
下列實驗操作能達到目的的是
實驗目的 | 實驗操作 | |
A | 制備Fe(OH)3膠體 | 將NaOH濃溶液滴加到飽和FeCl3溶液中 |
B | 配制氯化鐵溶液 | 將氯化鐵溶解在較濃的鹽酸中再加水稀釋 |
C | 確定Na2SO3樣品是否部分被 氧化 | 取樣于試管中,加入稀硝酸酸化,再滴加BaCl2溶液,觀察是否有白色沉淀生成 |
D | 檢驗乙醇發生消去反應生成 乙烯 | 將生成的氣體直接通入盛有酸性高錳酸鉀溶液的試劑瓶,觀察溶液是否褪色 |
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三模擬一化學試卷(解析版) 題型:選擇題
X、Y、Z、W均為短周期元素,且Y、Z、W在周期表的位置關系如下。已知X與W能形成最簡單的有機物,則下列有關說法正確的是
|
|
| W |
Y | Z |
|
|
A.X能分別與Y、W形成化合物,且其所含化學鍵類型完全相同
B.W有多種同素異形體,且均具有高熔點、高沸點的性質
C.X的離子半徑一定小于與Y同族的短周期元素的離子半徑
D.Y、Z與X的常見穩定液態氧化物反應的劇烈程度Y大于Z
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三上質檢二化學卷(解析版) 題型:實驗題
焦亞硫酸鈉(Na2S2O5)是一種食品添加劑.實驗室用如圖1所示裝置制備Na2S2O5,實驗步驟如下:

Ⅰ.在Na2CO3溶液中通入SO2 至pH為4.1,生成NaHSO3溶液;
至pH為4.1,生成NaHSO3溶液;
Ⅱ.加碳酸鈉粉末調至pH為7~8;
Ⅲ.再通SO2至pH為4.1;
Ⅳ.從過飽和溶液中析出Na2S2O5晶體.
(1)制備焦亞硫酸鈉總反應的化學方程式為 .
(2)Na2S2O5溶于水且與水能反應,所得溶液顯酸性,其原因是 .步驟Ⅲ中測定溶液的pH的方法是 ;pH>4.1時,則產品中會有副產物,其化學式是 .
(3)利用碘量法可測定Na2S2O5產品中+4價硫的含量,實驗方案為:將一定量的Na2S2O5產品放入碘量瓶(帶磨口塞的錐形瓶)中, ,重復如上步驟2次,記錄數據.(實驗中必須使用的試劑有:c1mol•L﹣1的標準碘溶液、c2mol•L﹣1的標準Na2S2O3溶液、冰醋酸、淀粉溶液、蒸餾水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)
(4)含鉻廢水中常含有六價鉻[Cr(Ⅵ)].利用Na2S2O5和FeSO4•7H2O先后分兩個階段處理含Cr2O72﹣的廢水,實驗結果如圖.
①實驗過程中 溶液的pH不斷升高的原因是 .
溶液的pH不斷升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31,lg2≈0.3,c(Cr3+)<1.0×10﹣5mol•L﹣1時視為完全沉淀.現將廢水中Cr2O72﹣全部轉化為Cr(OH)3而除去,需調節溶液的pH范圍為 .
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三上質檢二化學卷(解析版) 題型:選擇題
下列實驗設計及其對應的離子方程式均正確的是
A.用濃鹽酸與鐵屑反應制取H2:2Fe+6H +=2Fe3++3H2↑
+=2Fe3++3H2↑
B.用濃鹽酸酸化的KMnO4溶液與H2O2反應,證明H2O2具有還原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
C.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
D.將氯氣溶于水制備次氯酸:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化學 來源:2017屆海南省高三上學期期末化學試卷(解析版) 題型:選擇題
核反應不僅能發電也能制造元素.2016 年初國際上確認,利用原子核間的撞擊已制造出原子序數分別為113、115、117 和118 四種新元素,填補了目前元素周期表的空白,其中113 號元素與Al 元素處于同一主族.下列說法正確的是( )
A. 核反應發電實現了化學能到電能的轉化
B. 115 號元素一定是處于VA 族的非金屬元素
C. 117 號元素與F 、Cl 、Br 、I 均處于VIIA 族
D. 四種新元素位于元素周期表中的不同周期
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com