
乳酸亞鐵([CH3CH(OH)COO]2Fe.3H2O,Mr=288)是一種常用的補鐵劑,可通過是一種常用的補鐵劑,可通過乳酸與碳酸亞鐵反應制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。
某興趣小組用FeCl2(用鐵粉和稀鹽酸制得)和NH4HCO3制備FeCO3的裝置示意圖如下:
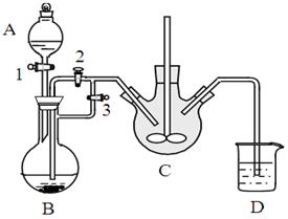
回答下列問題:
(1)NH4HCO3盛放在裝置 中(填字母),該裝置中涉及的主要反應的離子方程式____________。
(2)將生成的FeCl2溶液和NH4HCO3溶液混合時的操作是_________________。
(3)將制得的FeCO3加入到足量乳酸溶液中,再加入少量鐵粉,75℃下攪拌反應。鐵粉的作用是________,
反應結束后,無需過濾,除去過量鐵粉的方法是 。
(4)該興趣小組用KMnO4法測定樣品中亞鐵含量進而計算產品中乳酸亞鐵的質量分數,高錳酸鉀標準液用_________滴定管盛裝(填“酸式”或“堿式”)。下列操作會引起測定結果偏高的是_________。
A.滴定管在盛裝高錳酸鉀前未潤洗
B.滴定過程中,錐形瓶震蕩的太劇烈,以致部分液體濺出
C.滴定前讀數正確,滴定終點時俯視讀數
D.滴定前讀數正確,滴定終點時仰視讀數
(5)經查閱文獻后,該興趣小組改用鈰(Ce)量法測定產品中Fe2+的含量。取2.880g產品配成100mL溶液,每次取20.00mL,進行必要處理,用0.1000mol·L-1Ce(SO4)2標準溶液滴定至終點,平均消耗Ce(SO4)2 19.70mL。滴定反應如下:Ce4++Fe2+=Ce3++Fe3+,則產品中乳酸亞鐵的質量分數為 。
科目:高中化學 來源:2016-2017學年甘肅省高一上期中化學卷(解析版) 題型:選擇題
G、Q、X、Y、Z均為氯的含氧化合物,我們不了解它們的化學式,但知道它們在一定條件下具有如下的轉換關系(為配平):
①G→Q+NaCl
②Q+H2O →X+H2
③ Y+NaOH →G+Q+H2O
④Z+NaOH→Q+X+H2O
這五種化合物中 氯的化合價由低到高的順序為
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省、醴陵四中高二上期中化學卷(解析版) 題型:選擇題
下列反應屬于吸熱反應的是( )
A.炭燃燒生成一氧化碳 B.Ba(OH )2·8H2O與NH4Cl反應
)2·8H2O與NH4Cl反應
C.鋅粒與稀硫酸反應制取H2 D.中和反應
查看答案和解析>>
科目:高中化學 來源:2017屆四川省高三上綜合測試三化學卷(解析版) 題型:實驗題
某探究小組用KMnO4酸性溶液與H2C2O4溶液反應中溶液紫色消失快慢的方法,研究影響反應速率的因素。實驗條件作如下限定:所用酸性KMnO4溶液的濃度可選擇0.010 mol•L-1、0.0010 mol•L-1, 催化劑的用量可選擇0.5 g、0 g,實驗溫度可選擇298 K、323 K。每次實驗KMnO4酸性溶液的用量均為4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均為4 mL。
(1)寫出反應的離子方程式:
(2)請完成以下實驗設計表:完成④的實驗條件,并將實驗目的補充完整。
實驗 編號 | T/K | 催化劑的用量 / g | 酸性KMnO4溶液的濃度/mol•L-1 | 實驗目的 |
① | 298 | 0.5 | 0.010 | a. 實驗①和②探究酸性KMnO4溶液的濃度對該反應速率的影響; b.實驗①和③探究 對反應速率的影響 c. 實驗①和④探究催化劑對反應速率的影響。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)該反應的催化劑選擇MnCl2還是MnSO4 ,簡述選擇的理由 。
(4)某同學對實驗①和②分別進行了三次實驗,測得以下數據(從混合振蕩均勻開始計時):
實驗編號 | 溶液褪色所需時間 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、實驗②中用KMnO4的濃度變化來表示的平均反應速率為 (忽略混合前后溶液的體積變化)。
b、該同學分析上述數據后得出“當其他條件相同的情況下,酸性KMnO4溶液濃度越小,所需時間就越短,亦即其反應速率越快”的結論,你認為是否正確 (填“是”或“否”)。
C、某同學認為不用經過計算,直接根據褪色時間的長短就可以判斷濃度大小與反應速率的關系,你認為應該如何設計實驗 。
查看答案和解析>>
科目:高中化學 來源:2017屆四川省高三上綜合測試三化學卷(解析版) 題型:選擇題
下列說法不正確的是
A.硫酸可用于精煉石油、金屬加工之前的酸洗
B.氨易液化,常用作制冷劑
C.二氧化硫可用來加工食品,以使食品增白
D.硅是半導體材料,用作光電池
查看答案和解析>>
科目:高中化學 來源:2017屆陜西西安市高三上模擬三化學試卷(解析版) 題型:選擇題
下列物質的除雜方案正確的是
選項 | 被提純的物質 | 雜質 | 除雜試劑 | 除雜方法 |
A | CO2(g) | SO2(g) | 飽和Na2CO3溶液、濃H2SO4 | 洗氣 |
B | NH4Cl(ap) | Fe3+(ap) | NaOH溶液 | 過濾 |
C | NaCl(s) | KNO3(g) | AgNO3溶液 | 過濾 |
D | Cu(s) | Ag(s) | CuSO4 | 電解法 |
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三上期中化學試卷(解析版) 題型:填空題
合金是建筑航空母艦的主體材料。
(1)航母升降機可由鋁合金制造。
①鋁元素在周期表中的位置是________________,工業煉鋁的原 料由鋁土礦提取而得,提取過程中通入的氣體為______________。
料由鋁土礦提取而得,提取過程中通入的氣體為______________。
②Al—Mg合金焊接前用NaOH溶液處理Al2O3膜,其化學方程式為____________________。焊接過程中使用的保護氣為__________________(填化學式)。
(2)航母艦體材料為合金鋼。
①艦體在海水中發生的電化學腐蝕主要為_______________腐蝕。
②航母用鋼可由低硅生鐵冶煉而成,則在煉鐵過程中為降低硅含量需加入的物質為 。
(3)航母螺旋槳主要用銅合金制造。
①80.0 g Cu—Al合金用酸完全溶解后,加入過量氨水,過濾得到白色沉淀39.0 g,則合金中Cu的質量分數為___________________。
②為分析某銅合金的成分,用酸將其完全溶解后,用NaOH溶液調節pH,當pH=3.4時開始出現沉淀,分別在pH為7.0、8.0時過濾沉淀。結合下圖信息推斷該合金中除銅外一定含有______________。
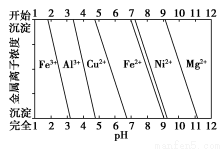
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三上期中化學試卷(解析版) 題型:選擇題
某化學小組為測定一定質量的某銅鋁混合物中銅的質量分數,設計了如下實驗方案:

下列有關判斷中不正確的是( )
A.溶液A和B均可以是鹽酸或NaOH溶液
B.溶液A和B均可以選用稀硝酸
C.若溶液B選用濃硝酸,則測得銅的質量分數偏小
D.實驗方案Ⅱ更便于實施
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省南京市高二上學期期中化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.綠色食品就是指顏色為綠色的食品 B.白色污染是指白色的廢棄物的污染
C.有機食品是指含有有機物的食品 D.食鹽加碘實質是在食鹽中加入KIO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com