
分析 ①普通玻璃成分是:二氧化硅,硅酸鈉和硅酸鈣;石英和碳酸鈉高溫下反應生成Na2SiO3和CO2;
②鋼鐵是金屬鐵和碳的合金;根據鐵器件的烤藍原理解答;形成原電池后,會加快負極金屬的腐蝕速率,正極金屬始終被保護.
③硫化前后,橡膠橡膠分子發生了變化生成了別的大分子有機物,結構由鏈狀變成了網狀.
解答 解:①工業制玻璃主要原料有石英、純堿和石灰石,高溫下,碳酸鈣和二氧化硅反應生成硅酸鈣和二氧化碳,高溫下,碳酸鈉和二氧化硅反應生成硅酸鈉和二氧化碳,所以普通玻璃主要成分是Na2SiO3、CaSiO3和SiO2;石英和碳酸鈉高溫下反應生成Na2SiO3和CO2:SiO2+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑.
故答案為:SiO2;SiO2+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑.
②鋼鐵是鐵和碳的合金;增強鐵器件的抗腐蝕能力,烤藍是利用堿性氧化性溶液的氧化作用,在鋼鐵表面形成一層深藍色的Fe3O4薄膜,保護內部金屬免受腐蝕;當鍍鋅的鐵的鍍層被損壞后,金屬鐵、鋅以及電解質形成原電池,金屬鐵為正極,被被保護起來,這時被腐蝕速度比普通鐵慢.故答案為:碳;Fe3O4;慢.
③硫化前后,橡膠橡膠分子發生了變化生成了別的大分子有機物,結構由鏈狀變成了網狀,故答案為:硫化.
點評 本題考查內容較多,是一道綜合題,側重考查了玻璃的成分、鐵的冶煉原理、金屬的吸氧腐蝕以及金屬的防護知識,注意知識的積累和教材知識的靈活應用是解題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
 (1)鉻的外圍電子排布式是3d54s1,與鉻同周期,最外層有3個未成對電子數的元素名稱是砷,該元素對應的最低價氫化物分子的中心原子采取
(1)鉻的外圍電子排布式是3d54s1,與鉻同周期,最外層有3個未成對電子數的元素名稱是砷,該元素對應的最低價氫化物分子的中心原子采取| 元 素 | X | Y | Z |
| 電 負 性 | 1.5 | 1.2 | 1.8 |
| 第一電離能/kJ•mol-1 | 578 | 738 | 787 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
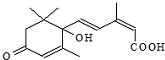
| A. | 分子式C15H21O4 | |
| B. | 既能發生加聚反應,又能發生縮聚反應 | |
| C. | 分子中有三種官能團 | |
| D. | 既能使氯化鐵溶液發生顯色反應,又能使酸性高錳酸鉀溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硝酸電離出的H+離子,能被Zn、Fe等金屬還原成H2 | |
| B. | 濃HNO3與濃HCl按3:1的體積比所得的混合物叫王水 | |
| C. | 硝酸與金屬反應時,主要是+5價的氮元素得電子 | |
| D. | 常溫下,向濃HNO3中投入Fe片,會產生大量的紅棕色氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,B2H6和C2H4的混合氣體22.4L,所含的電子數約為16NA | |
| B. | 1mol甲基(-CH3)所含電子數為9NA | |
| C. | 標準狀況下,1L庚烷所含有的分子數為$\frac{{N}_{A}}{22.4}$ | |
| D. | 26g C2H2和苯蒸氣的混合氣體中所含的C原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④ | B. | ②③⑧ | C. | ③④⑤⑦⑧ | D. | ②⑥⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
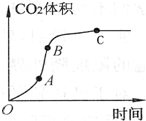 某學生用優質大理石與稀鹽酸反應制取CO2,(不考慮反應過程中溶液體積
某學生用優質大理石與稀鹽酸反應制取CO2,(不考慮反應過程中溶液體積| A. | AB段反應速率最快的原因可能是反應放熱,體系溫度升高 | |
| B. | BC段反應速率變慢的原因可能是鹽酸濃度降低 | |
| C. | 該反應速率也可以用CaCl2的濃度變化與時間關系來表示 | |
| D. | C點后CO2體積不變的原因一定是鹽酸消耗完 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2可以使Br2水褪色,是因為SO2具有漂白性 | |
| B. | Na的金屬活性比Mg強,故可用Na與MgCl2溶液反應制Mg | |
| C. | Fe在Cl2中燃燒生成FeCl3,故Fe與I2反應生成FeI3 | |
| D. | 可以用鋁制的容器儲存和運輸濃硝酸是因為常溫下鋁遇到濃硝酸鈍化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com