
【題目】NA表示阿伏加德羅常數的值,下列說法正確的是( )
A. 標準狀況下,以任意比例混合的氧氣和二氧化碳混合物22.4 L,所含的分子數為NA
B. 標準狀況下,1 L汽油(分子式為C8H18)完全燃燒后,所生成氣體產物的分子數為8NA/22.4
C. 標準狀況下,1 L SO3所含分子數為NA/22.4
D. 標準狀況下,以任意比混合的氫氣和一氧化碳氣體共8.96 L,在足量氧氣中充分燃燒時消耗氧氣的分子數為0.4NA
 全優測試卷系列答案
全優測試卷系列答案 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:
【題目】下列離子檢驗的方法正確的是( )
A. 向某溶液中加入硝酸銀溶液,生成白色沉淀,說明原溶液中有Cl-
B. 向某溶液中加入氯化鋇溶液,生成白色沉淀,說明原溶液中有SO![]()
C. 向某溶液中加入氫氧化鈉溶液,生成藍色沉淀,說明原溶液中有Cu2+
D. 向某溶液中加入氯化鋇溶液,生成白色沉淀,再加鹽酸沉淀不溶解,說明原溶液中有SO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸亞鐵(FeC2O4·2H2O)可用于制備磷酸鐵鋰電池正極材料。實驗室制備草酸亞鐵并測定其組成的實驗流程如下:

(1) “溶解”時加熱的目的是_____________________;“沉鐵”時將溶液煮沸并在不斷攪拌下加入H2C2O4溶液,“不斷攪拌”除可使反應物充分接觸外,另一目的是_____________________。
(2) “過濾、洗滌”時,能說明沉淀已洗滌干凈的依據是_____________________。
(3)按以下步驟可以測定產品中草酸根的質量分數。
①稱取0.1600g草酸亞鐵于錐形瓶中,加入25mL2mol·L-1的H2SO4溶液,加熱至40~50℃,使樣品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸約10min。
④將濾液過濾至另一個錐形瓶中,用10mL1mol·L-1的H2SO4溶液洗滌錐形瓶,將全部Fe2+轉移入錐形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液體積8.00 mL。
(I)測得的產品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)請計算產品中C2O![]() 的質量分數(寫出計算過程)。______________
的質量分數(寫出計算過程)。______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用濃度為0.1000mol·L-1的NaOH溶液滴定20.00mL濃度為0.1000mo l·L-1的某酸HX,滴定曲線如圖所示。下列說法正確的是( )

A. HX的電離常數Ka的數量級為10-10
B. P點溶液中微粒濃度大小為:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定過程中可選用的指示劑有甲基橙和酚酞
D. A點到B點過程中,水電離出的c(H+)×c(OH-)先增大,后不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列說法中正確的是
A.BaCO3可以轉化為BaSO4 ,反過來則不行
B.BaCO3、BaSO4均不溶于水,所以都可以做鋇餐試劑
C.向Na2CO3溶液中加入BaCl2和Na2SO4,當兩種沉淀共存時,c(SO42—)/ c(CO32—) = Ksp(BaCO3) / Ksp(BaSO4)
D.常溫下,BaCO3固體若要在Na2SO4溶液中開始轉化為BaSO4,則Na2SO4的濃度須大于2.2×10-6 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、R、M六種元素,位于元素周期表的前四周期,它們的核電荷數依次增大,相關信息如下:
元素 | 相關信息 |
X | 其單質為固體,常作電極材料 |
Y | 原子核外有6種不同運動狀態的電子 |
Z | 非金屬元素,基態原子的s軌道的電子總數與p軌道的電子總數相同 |
W | 主族元素,與Z原子的價電子數相同 |
R | 價層電子排布為3d64s2 |
M | ⅠB族,其單質常用作導線 |
請回答下列問題(答題時,X、Y、Z、W、R、M用所對應的元素符號表示):
(1)X的單質與Z的單質反應的產物為_____________。(填化學式)。
(2)Z、W相比,第一電離能較大的是_____________,M2+的核外電子排布式為_____________。
(3)M2Z的熔點比M2W的_____________(填“高”或“低”),請解釋原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型為__________,其中Y原子的雜化軌道類型為____________;N3-和YZ2互為等電子體,則N3-的結構式為_____________。
(5)MRW2的晶胞如圖所示,晶胞參數a=0.524nm,c=1.032nm;MRW2的晶胞中每個M原子與_________個W原子相連,晶體密度ρ=________g·cm-3(只要求列算式,不必計算出數值,NA=6.02×1023mol-1)。
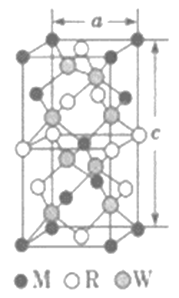
【答案】 Li2O O [Ar]3d9或1s22s22p63s23p63d9 高 O2-半徑比S2-半徑小,Cu2O比Cu2S的晶格能大,所以Cu2O的熔點高 直線形 sp雜化 [N=N=N]- 4 ![]()
【解析】X、Y、Z、W、R、M六種元素,位于元素周期表的前四周期,它們的核電荷數依次增大。Y的原子核外有6個不同運動狀態的電子,Y為C元素;X的單質為固體,常用作電極材料,X只能為Li元素;Z 是非金屬元素,基態原子的s軌道的電子總數與p軌道的電子總數相同,Z的電子排布式為1s22s22p4,為O元素;W是主族元素,與Zspan>原子的價電子數相同 ,W為S元素;R 的價層電子排布式為3d64s2,R為Fe元素;M位于第IB族,其被稱作“電器工業的主角”,為Cu元素。
(1)鋰與氧氣反應生成氧化鋰,故答案為:Li2O;
(2)同一主族,從上到下,第一電離能逐漸減小,O和S元素相比,第一電離能較大的是O,Cu2+的核外電子排布式為[Ar]3d9,故答案為:O;[Ar]3d9;
(3)氧離子半徑比硫離子半徑小,Cu2O比Cu2S的晶格能大,所以Cu2O熔點高,故答案為:高;氧離子半徑比硫離子半徑小,Cu2O比Cu2S的晶格能大,所以Cu2O熔點高;
(4)CO2中的C采用sp雜化,VSEPR 模型為直線型;N3-和CO2是等電子體,則N3-的結構式為[N=N=N]-,故答案為:直線型; sp;[N=N=N]-;
(5)由面心上Cu與2個S相連,晶胞中每個Cu原子與4個S相連;8個S均在體內,由化學式為CuFeS2,則含晶胞質量為![]() ,晶胞參數a=0.524nm,c=1.032nm,體積為(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞參數a=0.524nm,c=1.032nm,體積為(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
=![]() gcm-3,故答案為:4;
gcm-3,故答案為:4;![]() 。
。
點睛:本題考查晶胞計算及雜化等,為高考常見題型和高頻考點,側重于學生的分析能力的考查,把握物質結構與性質、晶胞結構及計算等為解答該題的關鍵。本題的難點是晶胞的計算。
【題型】推斷題
【結束】
12
【題目】芳香烴A是基本有機化工原料,由A制備高分子E和醫藥中間體K的合成路線(部分反應條件略去)如圖所示:
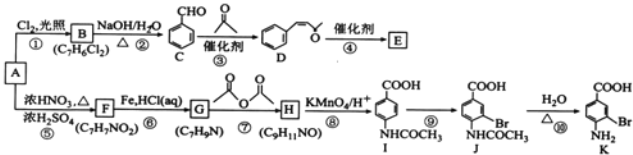
已知: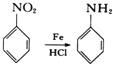 ;有機物分子中,同一個碳原子上連接有兩個羥基時不穩定,會自動脫水。
;有機物分子中,同一個碳原子上連接有兩個羥基時不穩定,會自動脫水。
回答下列問題:
(1)A的名稱是_____________。K含有官能團的名稱是__________________。
(2)反應⑦的作用是____________________________,⑩的反應類型是____________________________。
(3)寫出反應②的化學方程式:____________________________________________________________。
(4)D分子中最多有_____________個原子共平面。E的結構簡式為_____________。
(5)1molD與1molH2的加成產物同時滿足下列條件的同分異構體有_____________種。
①苯環上只有四種不同化學環境的氫原子;
②能與FeCl3發生顯色反應;
③分子中只存在一個環不含其它環狀結構。
(6)將由D為起始原料制備![]() 的合成路線補充完整。
的合成路線補充完整。
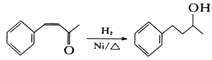 _________________________(無機試劑及溶劑任選)。合成路線流程圖示例如下:CH3CHO
_________________________(無機試劑及溶劑任選)。合成路線流程圖示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,0.lmol/L的HA溶液中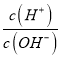 =1010,0.01mol/L的BOH溶液pH=12。請回答下列問題:
=1010,0.01mol/L的BOH溶液pH=12。請回答下列問題:
(1)HA是_________(填“強電解質”或“弱電解質”,下同),BOH是_______ 。
(2)HA的電離方程式是________。其中由水電離出的c(H+)=____mol/L。
(3)在加水稀釋HA的過程中,隨著水量的增加而減小的是____ (填字母)。
A.  B.
B.  C. c(H+)與c(OH-)的乘積 D.c(OH-)
C. c(H+)與c(OH-)的乘積 D.c(OH-)
(4)將等體積等物質的量濃度的HA溶液和BOH溶液混合后的溶液呈________性,請用離子方程式解釋其原因______________________。
(5)常溫下pH=12的BOH溶液100mL,加0.01mol/LNaHSO4,使溶液的pH為11。(混合溶液體積變化忽略不計),應加NaHSO4________mL。 (保留到小數點后一位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列括號內為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據有關數據回答下列問題:
(鹽酸 分子式:HCl 相對分子量:36.5 密度:1.2 g/mL HCl質量分數:36.5%)
(1)該濃鹽酸中HCl的物質的量濃度為______________。
(2)取用任意體積的該鹽酸時,下列物理量中不隨所取體積的多少而變化的是________(填字母)。
A.溶液中HCl的物質的量
B.溶液的濃度
C.溶液中Cl-的數目
D.溶液的密度
(3)某學生欲用上述濃鹽酸和蒸餾水配制500 mL物質的量濃度為0.4 mol·L-1的稀鹽酸。可供選用的儀器有:膠頭滴管、玻璃棒、燒杯、藥匙、量筒、托盤天平。
①配制稀鹽酸時,還缺少的儀器有______________(寫儀器名稱);該儀器上標有以下五項中的______ (填字母)。
A.溫度 B.濃度 C.容量 D.壓強 E.刻度線
②該學生需要量取__________mL上述濃鹽酸進行配制。
③在配制過程中,下列實驗操作對所配制的稀鹽酸的物質的量濃度有何影響?(在括號內填A表示“偏大”、填B表示“偏小”、填C表示“無影響”)
a.用量筒量取濃鹽酸時俯視觀察凹液面。(____)
b.量筒量取濃鹽酸后又用蒸餾水洗滌2~3次,并將洗液移入容量瓶中。(____)
(4)①假設該同學成功配制了0.4 mol·L-1的鹽酸,他又用該鹽酸中和含0.4 g氫氧化鈉的溶液,則該同學需取__________mL鹽酸。
②假設該同學用新配制的鹽酸中和含0.4g 氫氧化鈉的氫氧化鈉溶液,發現比①中所求體積偏小,則可能的原因是____________________________(填字母)。
A.濃鹽酸揮發,濃度不足
B.配制溶液時,未洗滌燒杯
C.配制溶液時,俯視容量瓶刻度線
D.加水時超過刻度線,用膠頭滴管吸出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化鉀樣品中含有少量碳酸鉀、硫酸鉀和不溶于水的雜質。為了提純氯化鉀,先將樣品溶于適量水中,充分攪拌后過濾,再將濾液按下圖所示步驟進行操作。

回答下列問題:
(1)檢驗濾液中的![]() 的方法是____________。
的方法是____________。
(2)試劑I的化學式為__________,加入試劑I后,①對應的實驗操作是____,①中發生反應的離子方程式為__________。
(3)試劑II的化學式為_________,②中加入試劑II的目的是______。
(4)試劑III的名稱是________,③中發生反應的離子方程式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com