
| A. | 在標準狀況下,1L庚烷完全燃燒后,所生成的氣態產物的分子數為$\frac{7}{22.4}$NA | |
| B. | 1mol碳正離子CH5+所含的電子數為10NA | |
| C. | 56g鐵粉在1mol氯氣中充分燃燒,失去的電子數為3NA | |
| D. | 0.5molC3H8分子中含C-H共價鍵2NA |
分析 A.庚烷標況下不是氣態;
B.碳正離子(CH5+)所含的電子總數為6+5-1=10;
C.56g鐵粉即1mol鐵粉在1mol氯氣中燃燒,鐵粉過量;
D.丙烷分子中含C-H鍵8個.
解答 解:A.標況下庚烷不是氣體,不能使用標況下的氣體摩爾體積計算1L庚烷的物質的量,故A錯誤;
B.1mol碳正離子CH5+含有10mol電子,所含的電子數為10NA,故B正確;
C.56g鐵粉即1mol鐵粉在1mol氯氣中燃燒,鐵粉過量,氯氣完全反應,而由于氯氣反應后變為-1價,故1mol氯氣得2mol電子,則鐵粉失去的電子為2mol,即為2NA個,故C錯誤;
D.0.5mol丙烷中含有4mol碳氫鍵,含C-H共價鍵4NA,故D錯誤;
故選B.
點評 本題考查了阿伏伽德羅常數的分析應用,主要是物質結構分析,氣體摩爾體積的應用條件理解,掌握基礎是關鍵,題目較簡單.


科目:高中化學 來源: 題型:解答題
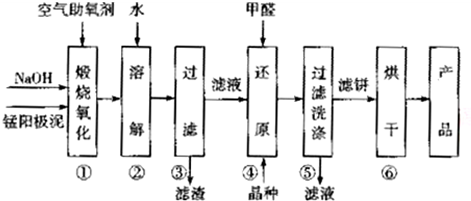
| 物質 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 難溶 |
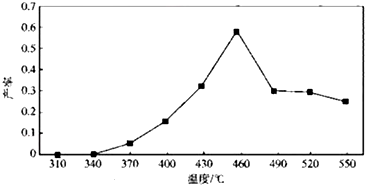
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
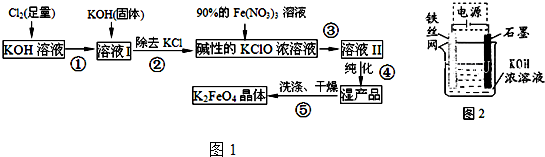
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
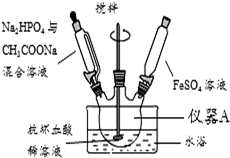 磷酸亞鐵[Fe3(PO4)2•8H2O]為白藍色晶體,溶于強酸,不溶于水、醋酸和乙醇.主要用于制造磷酸鐵鋰電池.實驗室制備磷酸亞鐵的裝置示意圖如圖、反應和實驗步驟如下.
磷酸亞鐵[Fe3(PO4)2•8H2O]為白藍色晶體,溶于強酸,不溶于水、醋酸和乙醇.主要用于制造磷酸鐵鋰電池.實驗室制備磷酸亞鐵的裝置示意圖如圖、反應和實驗步驟如下.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測氫氧化鈉溶液的體積(ml) | 0.1000mol?L-1鹽酸的體積(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
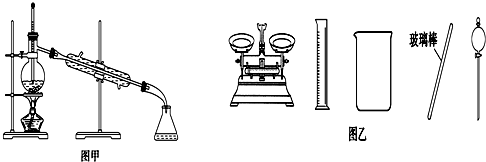
| A. | 聞未知液體氣味時,應該將試劑瓶口距離口鼻遠一些,用手輕輕扇動 | |
| B. | 將碘單質從碘的CCl4溶液中分離出來可用如圖甲所示實驗裝置 | |
| C. | 用容量瓶配制好一定濃度的某溶液后,塞緊瓶塞并在容量瓶上貼上標簽 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的儀器如圖乙所示 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.5molH2O含有的原子數目為1.5NA | B. | 0.5molNH3含有的電子數目為4NA | ||
| C. | 28gCO含有的分子數目為NA | D. | 2NA個氯氣分子的物質的量是2mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com