
| n |
| V |
| 1 |
| 6 |
| 1 |
| 6 |


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、是戊酸,同分異構體有4種 |
| B、是酯,在稀硫酸條件下水解的兩種產物的相對分子質量不可能相等 |
| C、可以發生銀鏡反應 |
| D、可以與溴水發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
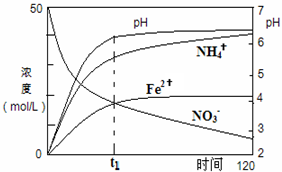 氮元素的化合物在工農業以及國防科技中用途廣泛,但也會對環境造成污染,如地下水中硝酸鹽造成的氮污染已成為一個世界性的環境問題.
氮元素的化合物在工農業以及國防科技中用途廣泛,但也會對環境造成污染,如地下水中硝酸鹽造成的氮污染已成為一個世界性的環境問題.查看答案和解析>>
科目:高中化學 來源: 題型:
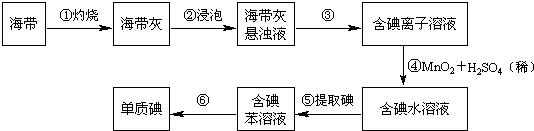
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、向氯水中加入有色布條,片刻后有色布條褪色,說明有Cl2存在 |
| B、向溶液中滴加酸化的Ba(NO3)2溶液出現白色沉淀,說明該溶液中一定有SO42- |
| C、Fe與稀HNO3、稀H2SO4反應均有氣泡產生,說明Fe與兩種酸均發生置換反應 |
| D、分別充滿HCl、NH3的燒瓶倒置于水中后液面均迅速上升,說明二者均易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實際應稱NaOH質量 | 應選用容量瓶的規格 | 實驗中的所需儀器 |
| ① | ② | 不需填寫 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| c(Pb2+) |
| c(NO3-) |
| 1 |
| 2 |
| c(Pb2+) |
| c(NO3-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com