
 如圖試管中盛有酸雨浸泡過的鐵釘,U形管中盛有一段紅墨水.開始時U型管左端紅墨水水柱下降,一段時間后U型管左端紅墨水水柱又上升.下列說法不正確的是( )
如圖試管中盛有酸雨浸泡過的鐵釘,U形管中盛有一段紅墨水.開始時U型管左端紅墨水水柱下降,一段時間后U型管左端紅墨水水柱又上升.下列說法不正確的是( )| A. | 開始時發生的是析氫腐蝕 | B. | -段時間后發生的是吸氧腐蝕 | ||
| C. | 兩段時間內負極的電極反應相同 | D. | 兩段時間內正極的電極反應相同 |
分析 酸雨的pH小于5.6,而酸性條件下,鋼鐵能發生析氫腐蝕,負極反應為:Fe-2e-═Fe2+,正極反應為:2H++2e-=H2↑,導致試管內氣體壓強增大;反應一段時間后,溶液的酸性減弱,鋼鐵腐蝕吸氧腐蝕,負極反應為:Fe-2e-═Fe2+,正極反應為:O2+2H2O+4e-=4OH-,導致試管內氣體壓強減小.據此分析.
解答 解:A、酸雨的pH小于5.6,電解質溶液顯酸性,故開始鋼鐵發生析氫腐蝕,故A正確;
B、反應一段時間后,溶液的酸性減弱,鋼鐵腐蝕吸氧腐蝕,故B正確;
C、無論是析氫腐蝕還是吸氧腐蝕,鐵都作負極,負極上發生的電極反應式都為Fe-2e-═Fe2+,故C正確;
D、開始時發生的是析氫腐蝕,正極反應為:2H++2e-=H2↑;后來發生的是吸氧腐蝕,正極反應為:O2+2H2O+4e-=4OH-,故兩段時間內的正極的電極反應不同,故D錯誤.
故選D.
點評 本題考查了原電池原理,明確鋼鐵發生析氫腐蝕和吸氧腐蝕所需溶液的酸堿性是解本題的關鍵,根據析氫腐蝕和吸氧腐蝕導致試管內氣體壓強的變化即可分析解答,難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 它是一種白色粉末,溶解度小于Na2CO3 | |
| B. | 加熱至200℃左右,可完全分解,利用這種性質,可由NaHCO3制取純堿 | |
| C. | 與Na2CO3相同質量時,分別跟足量鹽酸反應后,則NaHCO3可得到較多的二氧化碳 | |
| D. | 它是一種碳酸鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某反應的焓變小于零,該反應一定能自發進行 | |
| B. | 用濕潤的PH試紙測稀鹽酸溶液的pH為3.52 | |
| C. | 原電池是將化學能轉變為電能的裝置 | |
| D. | 草木灰(K2CO3)是鉀肥,硫酸銨是氮肥,兩者混合施用可以提高肥效 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
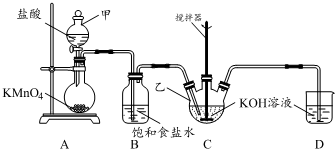 實驗室用圖所示裝置制備KClO溶液,并通過KClO溶液與Fe(NO3)3溶液的反應制備高效水處理劑K2FeO4.
實驗室用圖所示裝置制備KClO溶液,并通過KClO溶液與Fe(NO3)3溶液的反應制備高效水處理劑K2FeO4.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向硫酸銅溶液中加入過量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | NH4Al(SO4)2溶液與足量的Ba(OH)2溶液混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向Na2S2O3溶液中通入足量氯氣:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 鉛酸蓄電池充電時的陰極反應:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
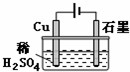
| A. | 電解過程中,銅電極上有H2產生 | |
| B. | 電解初期,主反應方程式為Cu+H2SO4$\frac{\underline{\;通電\;}}{\;}$CuSO4+H2↑ | |
| C. | 電解一定時間后,石墨電極上有銅析出 | |
| D. | 整個電解過程中,H+的濃度幾乎不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它們都能與水反應生成對應的酸 | |
| B. | 標準狀況下它們都是無色無味的氣體 | |
| C. | 分子中氧元素的質量分數:NO>NO2>SO2 | |
| D. | 實驗室可以利用氧化還原反應分別制備NO、NO2、SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com