15.NH
3在與酸反應、與鹽溶液反應時體現出堿性外,還有其它性質.
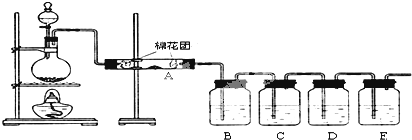
( I)(1)同學甲在百度中查閱工業制硝酸的原理:硝酸工業與合成氨工業密接相關,氨氧化法是工業生產中制取硝酸的主要途徑,其主要流程是將氨和空氣的混合氣(氧:氮≈2:1)通入灼熱(760~840℃)的鉑銠合金網,在合金網的催化下,氨被氧化成一氧化氮(NO).生成的一氧化氮利用反應后殘余的氧氣繼續氧化為二氧化氮,隨后將二氧化氮通入水中制取硝酸.稀硝酸、濃硝酸、發煙硝酸的制取在工藝上各不相同.反應在高溫高壓條件下進行.同學乙認為只要增大氧氣的含量,就可以直接氧化得到NO
2,再制備硝酸.請結合你所學習的化學知識,談談實際生產中的合理性.已知:2NO與O
2反應生成2NO
2是可逆反應.氨和空氣的混合氣在合金網的催化下,氨被氧化成一氧化氮(NO),氧氣繼續氧化為二氧化氮,反應增大氧氣的含量,可以促使化學反應正向移動,從而提高硝酸的產率
(2)工業上,NaNH
2用于制取靛青染料;LiNH
2主要用于有機合成和藥物制造,是具有良好前景的儲氫材料.科學家在液氨中加入金屬鈉或金屬鋰制備NaNH
2和LiNH
2,試寫出制備LiNH
2反應方程式:Li+2NH
3=LiNH
2+2H
2,NH
3表現氧化性.
(3)已知NH
3與Cl
2在一定條件下能發生反應,其中N元素被氧化為游離態,實際反應中其產物隨著n(NH
3):n(Cl
2)的比發生變化,經測定,產物中n(HCl):n(NH
4Cl)=1:1時,則n(NH
3):n(Cl
2)=5:3,整個反應過程被氧化的N與未被氧化的N物質的量之比為2:3結合以上信息,請寫出工業上檢驗氯氣管道是否漏氣的方法及現象:取濃氨水灑于管道口,產生白煙,證明此處漏氣
( II)二氧化氯(ClO
2)為一種黃綠色氣體,是國際上公認的高效、廣譜、快速、安全的殺菌消毒劑.
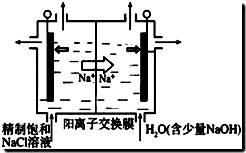
(1)目前已開發出用電解法制取ClO
2的新工藝.
①如圖示意用石墨做電極,在一定條件下電解飽和食鹽水制取ClO
2.寫出陽極產生ClO
2的電極反應式:Cl
--5e
-+2H
2O=ClO
2↑+4H
+.
②電解一段時間,當陰極產生的氣體體積為112mL(標準狀況)時,停止電解.通過陽離子交換膜的陽離子的物質的量為0.01mol;用平衡移動原理解釋陰極區pH增大的原因在陰極發生2H
++2e
-=H
2↑,H
+濃度減小,使得H
2O?OH
-+H
+的平衡向右移動,OH
-濃度增大,pH增大.
(2)ClO
2對污水中CN
-有明顯的去除效果.某工廠污水中含CN
- a mg/L,現用ClO
2將CN
-氧化,只生成兩種常見氣體,其離子反應方程式為2ClO
2+2CN
-=N
2↑+2CO
2↑+2Cl
-;處理100m
3這種污水,至少需要ClO
2$\frac{50a}{13}$mol.

 合成它的單體可能有( )
合成它的單體可能有( ) ) ②丙烯醇(CH2═CH-CH2OH)
) ②丙烯醇(CH2═CH-CH2OH)