
鈰元素(Ce)是鑭系金屬中自然豐度最高的一種,常見價態有+3、+4,鈰的合金耐高溫,可以用來制造噴氣推進器零件。
(1)霧霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物質的量之比為1∶1),該反應氧化劑與還原劑的物質的量之比為___________。
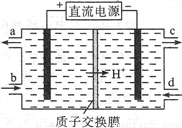
(2)可采用電解法將上述吸收液中的NO2-轉化為無毒物質,同時再生Ce4+,其原理如右圖所示。
①Ce4+從電解槽的__________(填字母序號)口流出。
②寫出陰極的電極反應式____________________________。每消耗1mol NO2-,陰極區H+物質的量減少______mol。
(3)鈰元素在自然中主要以氟碳礦形式存在,主要化學成分為CeFCO3,工業上利用氟碳鈰礦提取CeCl3的一種工藝流程如下:
①焙燒過程中發生的主要反應方程式為______________________________________。
②酸浸過程中有同學認為用稀硫酸和H2O2替換鹽酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分別為a、b,則Ce(BF4)3(s) + 3KCl(aq) 3KBF4(s) + CeCl3 (aq)平衡常數為______________________。
3KBF4(s) + CeCl3 (aq)平衡常數為______________________。
④加熱CeCl3·6H2O和NH4Cl的固體混合物可得到無水CeCl3,其中NH4Cl的作用是______________________。
科目:高中化學 來源:2016-2017學年福建省高一下學期開學考試化學試卷(解析版) 題型:計算題
按要求填空:
(1)0.2molO3和0.3molO2的質量___________(選填“相等”、“不相等”或“無法判斷”),分子數之比為__________,所含原子數之比為___________,在相同條件下的體積之比為_____________。
(2)73gHCl氣體中含有_____________個分子,標準狀況下占有的體積為_____________L。
(3)相同物質的量濃度的KCl、MgCl2、AlCl3三種溶液,分別與AgNO3溶液反應,當生成的AgCl的沉淀的質量之比為3:2:1時,三種溶液的體積比為__________。
(4)標準狀況下VL氯化氫氣體溶解在1L水中,所得溶液的密度為ρg•mL,溶液中溶質的質量分數為ω,物質的量濃度為cmol•L-1,則ω=__________(任寫一種表達式)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省廣州市高一上學期期期末考試化學試卷(解析版) 題型:選擇題
下列實驗能達到預期目的的是
編號 | 實驗內容 | 實驗目的 |
A | 向某待測液中通入Cl2 ,再滴入2滴KSCN溶液后,溶液變為血紅色 | 證明該待測液中一定含有Fe2+ |
B | 向某待測液中加入鹽酸,產生能使澄清石灰水變渾濁的氣體 | 證明該待測液中一定含有CO32- |
C | 把硫酸酸化的H2O2溶液滴入FeCl2溶液中,溶液變成黃色 | 證明H2O2氧化性大于Fe3+ |
D | 向Al(0H)3沉淀中分別加入鹽酸和氨水,沉淀都會溶解 | 證明Al(0H)3是兩性氫氧化物 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省高三2月月考理綜化學試卷(解析版) 題型:填空題
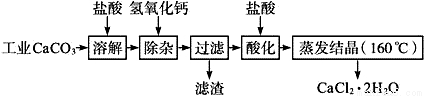
醫用氯化鈣可用于生產補鈣、抗過敏和消炎等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫藥級二水合氯化鈣(CaCl2、2H2O的質量分數為97.0%~103.0%)的主要流程如下:
已知:
氫氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
開始沉淀時的pH | 2.3 | 4.0 | 開始溶解時的pH | 7.8 |
完全沉淀時的pH | 3.7 | 5.2 | 完全溶解時的pH | 10.8 |
(1)CaCO3與鹽酸反應的離子方程式___________。
(2)“除雜”操作是加入氫氧化鈣,調節溶液的pH范圍為________,目的是除去溶液中的少量Al3+、Fe2+。
(3)過濾時需用的比玻璃器有__________。
(4)“酸化”操作是加入鹽酸,調節溶液的pH約為4.0,其目的有:①防止氫氧化鈣吸收空氣中的二氧化碳;②防止Ca2+在蒸發時水解;③_______。
(5)蒸發結晶要保持在160℃的原因是__________。
(6)測定樣品中Cl-含量的方法是:稱取0.750 0 gCaCl2·2H2O樣品,溶解,在250 mL容量瓶中定容;量取25.00 mL待測溶液于錐形瓶中;用0.050 00 mol/L AgNO3溶液滴定至終點(用K2Cr2O2),消耗AgNO3溶液體積的平均值為20.39 mL。
①上述測定過程中需用溶液潤洗的儀器有________。
②計算上述樣品中CaCl2·2H2O的質量分數為_______。(保留四位有效數字)
③若用上述方法測定的樣品中CaCl2·2H2O的質量分數偏高(測定過程中產生的誤差可忽略),其可能原因有________;__________。
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省高三2月月考理綜化學試卷(解析版) 題型:選擇題
我國古代科技高度發達,下列有關古代文獻的說法,錯誤的是
A. 晉代葛洪的《抱樸子》記載“丹砂燒之成水銀,積變又成丹砂”,是指加熱時丹砂(HgS)熔融成液態,冷卻時重新結晶為HgS晶體
B. 漢朝的《淮南萬畢術》、《神農本草經》記載“白青(堿式碳酸銅)得鐵化為銅”,“石膽…能化鐵為銅”都是銅可以用鐵來冶煉
C. 清初《泉州府志》物產條載:“初,人不知蓋泥法,元時南安有黃長者為宅煮糖,宅垣忽壞,去土而糖白,后人遂效之。”該段文字記載了蔗糖的分離提純采用了黃泥來吸附紅糖中的色素
D. 明朝的《本草綱目》記載“燒酒非古法也,自元時創始,其法用濃酒和糟入甑(指蒸鍋),蒸令氣上,用器承滴露。”該段文字記載了白酒(燒酒)的制造過程中采用了蒸餾的方法來分離和提純
查看答案和解析>>
科目:高中化學 來源:2017屆四川省高三2月月考理科綜合化學試卷(解析版) 題型:選擇題
短周期元素a、b、c、d原子序數依次增大。a的核外電子總數與其周期數相同,b的某種單質是空氣的主要成分,c的最外層電子數為其內層電子數的3倍,d與c同族;下列說法錯誤的是( )
A. a、b、d均可以與c形成兩種或多種二元化合物
B. 陰離子的還原性d大于c
C. a與d形成的化合物可以抑制水的電離
D. 常溫下,由這四種元素構成的某種鹽的溶液pH=4,則水電離出的H+濃度肯定是1×10-4mol/L
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三下學期期初考試化學試卷(解析版) 題型:填空題
以NaCl等為原料制備KClO4的過程如下:
①在無隔膜、微酸性條件下,發生反應:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl發生復分解反應,降溫結晶,得KClO3。
③一定條件下反應:4KClO3=3KClO4+KCl,將產物分離得到KClO4。
(1)電解時,產生質量為2.13g NaClO3,同時得到H2的體積為____________L(標準狀況)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)該過程制得的KClO4樣品中含少量KCl雜質,為測定產品純度進行如下實驗:
準確稱取5.689g樣品溶于水中,配成250mL溶液,從中取出25.00mL于錐形瓶中,加入適量葡萄糖,加熱使ClO4-全部轉化為Cl- (反應為:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示劑,用0. 20mol/L AgNO3溶液進行滴定至終點,消耗AgNO3溶液體積21.00mL。滴定達到終點時,產生磚紅色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,則此時c(Cl-)=________________mol/L。
② 計算KClO4樣品的純度(請寫出計算過程。)______________________________
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省長沙市高二下學期第一次模塊檢測化學試卷(解析版) 題型:推斷題
咖啡酸苯乙酯 是一種天然抗癌藥物。在一定條件下能發生如下轉化。
是一種天然抗癌藥物。在一定條件下能發生如下轉化。

請回答下列問題:
(1)A分子中的官能團是_____________________。
(2)E→M的反應類型為________;B→C的反應類型為__________。
(3)高分子化合物M的結構簡式是____________________。
(4)寫出A→B反應的化學方程式:_____________________。
(5)A的同分異構體有很多種,其中同時符合下列條件的同分異構體有________種。
①苯環上只有兩個取代基 ②能發生銀鏡反應
③能與碳酸氫鈉溶液反應 ④能與氯化鐵溶液發生顯色反應
查看答案和解析>>
科目:高中化學 來源:2017屆江西省協作體高三下學期第一次聯考理綜化學試卷(解析版) 題型:填空題
MnO2是一種重要的無機功能材料,粗MnO2的提純是工業生產的重要環節.某研究性學習小組設計了將粗MnO2(含有較多的MnO和MnCO3)樣品轉化為純MnO2實驗,其流程如下
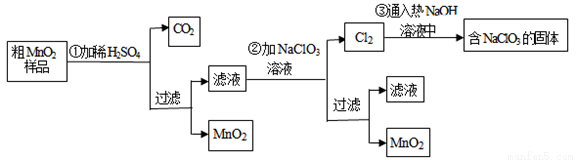
(1)第①步加稀H2SO4時,粗MnO2樣品中的_____________(寫化學式)轉化為可溶性物質.
(2)第②步反應的離子方程式:_______________________
(3)流程中得到MnO2固體操作必需的玻璃儀器有玻璃棒、燒杯、_______________。
(4)已知第③步蒸發得到的固體中有NaClO3和NaOH,則一定還有含有_________(寫化學式).其中用到Cl2的實驗室制法的反應離子方程式:_______________________。
(5)若粗MnO2樣品的質量為50.76g,第①步反應后,經過濾得到34.8g MnO2,并收集到0.896LCO2(標準狀況下),則在第②步反應中至少需要____________ g NaClO3.[M (NaClO3)=106.5]
(6)第①步酸溶產生的CO2與NH3反應可合成化肥尿素[化學式為CO(NH2)2]。己知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CONH2)2(s)+H2O(g); ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
寫出CO2與NH3合成尿素和液態水的熱化學反應方程式______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com