
【題目】下表為元素周期表中前四周期的部分元素,表中所列的字母分別代表一種化學元素,根據要求回答下列各小題:
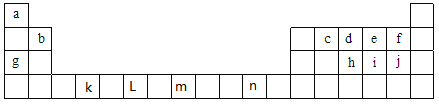
(1)①元素非金屬性強弱比較有很多方法,其中f和j的非金屬性強弱的研究方案中不可行的是_________(填序號)
a.比較兩種單質的顏色 b.比較氫化物的穩定性 c.依據兩元素在周期表的位置
d.比較電負性 e.比較最高價氧化物對應水合物的酸性
②根據元素原子的外圍電子排布的特征,可將元素周期表前四周期元素分成4個區域,分別為s區、p區、d區、ds區,則屬于s區的元素有_______種,屬于d區的元素有_______種;元素n屬于________區。
③在c、d、e三種元素中,電負性由小到大的順序是______________,第一電離能由大到小的順序是____________(用元素符號回答)。
(2)①寫出 n2+的核外電子排布式:______________________。
②寫出k元素基態原子的價電子排布式:_____________。
③寫出 L元素基態原子的外圍電子排布式:_____________。
④寫出m元素基態原子價電子的軌道表示式:________________________,該元素在元素周期表中的位置為:__________________________。
⑤j簡單陰離子的結構示意圖為____________。
(3)①元素i的氫化物分子屬于____________(填“極性”或“非極性”)分子,其分子的空間構型為____________,該氫化物分子中i原子軌道的雜化類型是__________; 由i與e形成的ie42-離子,其空間構型為__________(用文字描述)。
②已知cd- 與 d2 結構相似,1 mol cd- 中![]() 鍵數目為___________,由d形成的離子d3-與CO2互為等電子體,則d3-的分子構型為___________。
鍵數目為___________,由d形成的離子d3-與CO2互為等電子體,則d3-的分子構型為___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子構型為___________,其中氧原子的雜化方式為_______;
④化合物j2e的立體構型為_________,中心原子的價層電子對數為__________。
【答案】 ae 7種 8種 ds C<N<O N>O>C 1s22s22p63s23p63d9或[Ar]3d9 3d24s2 3d54s1 ![]() 第4周期第VIII族
第4周期第VIII族 ![]() 極性 V形 sp3 正四面體 2NA 直線形 V形 sp3 V形 4
極性 V形 sp3 正四面體 2NA 直線形 V形 sp3 V形 4
【解析】根據元素在周期表中的位置可知,a為H元素、b為Be元素、c為C元素、d為N元素、e為O元素、f為F元素、g為Na元素、h為P元素、i為S元素、j為Cl元素、k為Ti元素、L為Cr元素、m為Fe元素、n為Cu元素。
(1). ①. a.顏色屬于物理性質,不能比較非金屬性強弱,故a錯誤;b.非金屬性越強,氣態氫化物越穩定,可以比較非金屬性強弱,故b正確;c.f為F元素、j為Cl元素,同一主族元素,隨著原子序數增大,元素的非金屬性減弱,可以比較非金屬性強弱,故c正確;d.非金屬性越強,電負性越大,可以比較非金屬性強弱,故d正確;e.f為F元素,無最高價氧化物對應的水化物,不能比較非金屬性強弱,故e錯誤;答案選:ae;
②.s區包括IA族和IIA族,前四周期屬于s區的元素有:H、Li、Be、Na、Mg、K、Ca,共7種;d區包括IIIB~VIIB族和VIII族(鑭系元素和錒系元素除外),前四周期屬于d區的元素有:Sc、Ti、V、Cr、Mn、Fe、Co、Ni,共8種,n是Cu元素,位于IB族,屬于ds區元素,故答案為:7種;8種;ds;
③.元素的非金屬性越強,其電負性越大,在C、N、O三種元素中,非金屬性C<N<O,所以電負性C<N<O,同一周期的元素,隨著原子序數的增大,第一電離能呈增大趨勢,但N元素的2p能級為半充滿的穩定結構,所以第一電離能N>O>C,故答案為:C<N<O;N>O>C;
(2). ①.n為Cu元素,Cu是29號元素,則Cu2+的核外電子排布式為1s22s22p63s23p63d9或[Ar]3d9,故答案為:1s22s22p63s23p63d9或[Ar]3d9;
②.k為22號Ti元素,其基態原子的價電子排布式為3d24s2,故答案為:3d24s2;
③.L為24號Cr元素,其基態核外電子排布式為1s22s22p63s23p63d54s1,則Cr元素的基態原子的外圍電子排布式為3d54s1,故答案為:3d54s1;
④.m為26號Fe元素,其基態核外電子排布式為1s22s22p63s23p63d64s2,其基態原子的價電子軌道表示式為![]() ,Fe元素位于元素周期表的第4周期第VIII族,故答案為:
,Fe元素位于元素周期表的第4周期第VIII族,故答案為:![]() ;第4周期第Ⅷ族;
;第4周期第Ⅷ族;
⑤.j為Cl元素,Cl-的結構示意圖為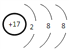 ,故答案為:
,故答案為: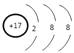 ;
;
(3). ①.H2S分子的中心原子價層電子對數為2+![]() =2+2=4,則S原子的雜化類型為sp3,孤電子對數為2,所以H2S分子的空間構型為V
=2+2=4,則S原子的雜化類型為sp3,孤電子對數為2,所以H2S分子的空間構型為V![]() =4+0=4,孤電子對數為0,則SO42-的空間構型為正四面體,故答案為:極性;V形;sp3;正四面體;
=4+0=4,孤電子對數為0,則SO42-的空間構型為正四面體,故答案為:極性;V形;sp3;正四面體;
②. 1個N2分子中含有1個σ鍵和2個π鍵,CN-與N2的結構相似,則1mol CN-中π鍵數目為2NA,CO2是直線形分子,N3-與CO2互為等電子體,則N3-的分子構型為直線形,故答案為:2NA;直線形;
③.F2通入稀NaOH溶液中可生成OF2,OF2分子的中心原子價層電子對數為2+![]() =2+2=4,孤電子對數為2,則其分子空間構型為V形,氧原子的雜化方式為sp3,故答案為:V形;sp3;
=2+2=4,孤電子對數為2,則其分子空間構型為V形,氧原子的雜化方式為sp3,故答案為:V形;sp3;
④.化合物Cl2O的中心原子價層對數為2+![]() =2+2=4,孤電子對數為2,則其立體構型為V形,故答案為:V形;4。
=2+2=4,孤電子對數為2,則其立體構型為V形,故答案為:V形;4。


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案科目:高中化學 來源: 題型:
【題目】已知液氨能和NaH反應放出H2:NaH + NH3 =NaNH2 + H2↑,它也能和Na反應放出H2。據此下列說法中錯誤的是( )
A. 液氨和NaH反應中,液氨是氧化劑
B. 液氨和NaH反應生成的H2既是氧化產物又是還原產物
C. 液氨和Na反應產物中有NaNH2
D. 液氨和NaH或Na反應都屬于置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷化硼是一種超硬耐磨涂層材料,右圖為其晶胞,其中的每個原子均滿足8電子穩定結構。下列有關說法正確的是( )

A. 磷化硼晶體的熔點很低
B. 磷化硼晶體的化學式為BP,屬于離子晶體
C. 磷化硼晶體中每個原子均形成4條共價鍵
D. 磷化硼晶體結構中微粒的空間堆積方式與氯化鈉相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子結構與元素周期表、元素性質三者關系密切。
A、B、D、E、F為原子序數依次增大的前四周期元素,其中A的最外層電子數是其內層電子數的2倍,B、D、E為同周期元素,B原子的核外電子總數是其未成對電子數的5倍,E原子最外層有1個未成對電子,F原子核外有22種運動狀態的電子。
請回答下列問題:
(1)F元素位于周期表_____________區,其價電子排布圖為:_____________。
(2)B、D、E三種元素中,第一電離能最小的是_____________ (填元素符號);寫出AD2的等電子體_____________ (分子和陰離子各寫一種)。
(3)AO2和DO2熔點高的是_____________,原因是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究晶體的結構對化學新材料的發現有著重要的價值。
(1)晶胞中任一個原子的中心位置均可用稱之為原子分數坐標的三個分別小于1的數(x,y,z)來予以規定。某晶體的晶胞結構如圖所示,1號原子坐標為(0,0,0),2號原子坐標為(1/3,2/3,0),該晶體的化學式為___________,該晶胞參數為:a = 250.4 pm, c = 666.1 pm,γ = 120o; 3號原子坐標為_____________,列出上述晶體中A和B兩原子間的最小核間距的計算式為_____________。(不必算出數值,但需要化簡)

(2)體心立方堆積的晶胞是個立方體,如果半徑為r的原子保持緊密接觸,立方體的中心能容得下半徑最大為___________的一個原子。
(3)Fe能形成多種氧化物,其中FeO晶胞結構為NaCl型。晶體中實際上存在空位、錯位、雜質原子等缺陷,晶體缺陷對晶體的性質會產生重大影響。由于晶體缺陷,在晶體中Fe和O的個數比發生了變化,變為FexO(x<1),若測得某FexO晶體密度為5.71 g·cm-3,晶胞邊長為4.28×10-10 m,則FexO中x=__________(結果保留兩位有效數字)。
(4)鈣鈦礦晶體的結構如圖所示。假設把氧離子看做硬球接觸模型,鈣離子和鈦離子填充氧離子的空隙,氧離子形成正八面體,鈦離子位于正八面體中心,則一個鈦離子被__________個氧離子包圍;鈣離子位于立方晶胞的體心,一個鈣離子被_____個氧離子包圍。鈣鈦礦晶體的化學式為__________。若氧離子半徑為a pm,則鈣鈦礦晶體中兩個鈦離子間最短距離為_______pm,鈦離子與鈣離子間最短距離為_______pm。

(5)鈦元素有兩種同素異形體,常溫下是六方堆積,高溫下是體心立方堆積。如圖所示F晶體的結構中,晶胞參數a=0.295nm,c=0.469nm,則該F晶體的密度為_____________ g· cm-3
(用NA表示阿伏加德羅常數的值,列出計算式即可,不用化簡)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于烷烴的敘述不正確的是( )
A. 烷烴只含有碳、氫兩種元素
B. 含有碳、氫元素的烴不一定是烷烴
C. 烷烴一定是飽和烴,飽和烴不一定是烷烴
D. 碳原子間只以單鍵相結合的烴一定是烷烴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,Fe(OH)2和Cu(OH)2的飽和溶液中,金屬陽離子的物質的量濃度的負對數[-lgc(M2+)]與溶液pH的變化關系如圖所示,已知該溫度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列說法正確的是
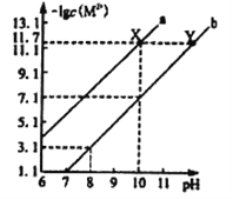
A. 曲線a表示Fe(OH)2飽和溶液中的變化關系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入適CuO
C. 當Fe(OH)2和Cu(OH)2沉淀共存時,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X點對應的飽和溶液中加入少量NaOH固體,可轉化為Y點對應的溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com