
某化合物的化學式為HnAO2n-1,若此化合物的式量為M,則元素A的相對原子質量為____。
科目:高中化學 來源:2011-2012學年河南省信陽高中高一下學期期中考試化學試卷(帶解析) 題型:實驗題
(15分)I.磷、硫元素的單質和化合物應用廣泛。
(1)磷元素的原子結構示意圖是 。
(2)磷酸鈣與焦炭、石英砂混合,在電爐中加熱到1500°C生成白磷,反應為:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 , 10C+P4O10==P4+10CO
每生成 1molP4時,就有 mol電子發生轉移。
(3)硫代硫酸鈉(Na2S2O3)是常用的還原劑。在維生素C(化學式C6H8O6)的水溶液中加入過量I2溶液,使維生素C完全氧化,剩余的I2 用Na2S2O3溶液滴定,可測定溶液中維生素C的含量。發生的反應為:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定體積的某維生素C溶液中加入amolL-1I2溶液V1ml,充分反應后,用Na2S2O3溶液滴定剩余的I2,消耗bmolL-1 Na2S2O3溶液V2ml.該溶液中維生素C的物質量是 mol。
(4)在酸性溶液中,碘酸鈉(KIO3)和亞硫酸鈉可發生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
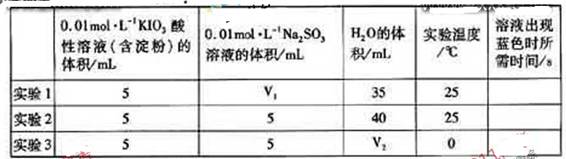
生成的碘可以用淀粉液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。某同學設計實驗如下表所示:
| | 0.01mol·L-1KIO3酸性溶液(含淀粉)的體積/mL | 0.01mol·L-1Na2SO3溶液的體積/mL | H2O的體積/mL | 實驗溫度/℃ | 溶液出現藍色時所需時間/s |
| 實驗1 | 5 | V1 | 35 | 25 | |
| 實驗2 | 5 | 5 | 40 | 25 | |
| 實驗3 | 5 | 5 | V2 | 0 | |
查看答案和解析>>
科目:高中化學 來源:2014屆河南省高一下學期期中考試化學試卷(解析版) 題型:實驗題
(15分)I.磷、硫元素的單質和化合物應用廣泛。
(1)磷元素的原子結構示意圖是 。
(2)磷酸鈣與焦炭、石英砂混合,在電爐中加熱到1500°C生成白磷,反應為:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 , 10C+P4O10==P4+10CO
每生成 1molP4 時,就有 mol電子發生轉移。
(3)硫代硫酸鈉(Na2S2O3)是常用的還原劑。在維生素C(化學式C6H8O6)的水溶液中加入過量I2溶液,使維生素C完全氧化,剩余的I2 用Na2S2O3溶液滴定,可測定溶液中維生素C的含量。發生的反應為:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定體積的某維生素C溶液中加入amolL-1I2溶液V1ml,充分反應后,用Na2S2O3溶液滴定剩余的I2,消耗bmolL-1 Na2S2O3溶液V2ml.該溶液中維生素C的物質量是 mol。
(4)在酸性溶液中,碘酸鈉(KIO3)和亞硫酸鈉可發生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。某同學設計實驗如下表所示:
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的體積/mL |
0.01mol·L-1Na2SO3溶液的體積/mL |
H2O的體積/mL |
實驗溫度/℃ |
溶液出現藍色時所需時間/s |
|
實驗1 |
5 |
V1 |
35 |
25 |
|
|
實驗2 |
5 |
5 |
40 |
25 |
|
|
實驗3 |
5 |
5 |
V2 |
0 |
|
該實驗的目的是______;表中V2=_________mL.
II稀土元素是寶貴的戰略資源,我國的蘊藏量居世界首位。
(5)在某強酸性混合稀土溶液中加入H2O2,調節pH ≈3. Ce3+通過下列反應形成Ce(OH)4沉淀得以分離。完成反應的離子方程式:
□Ce3++□H2O2+□H2O=====□Ce(OH)4↓+□
查看答案和解析>>
科目:高中化學 來源:2011年普通高等學校招生全國統一考試化學卷(福建) 題型:填空題
I.磷、硫元素的單質和化合物應用廣泛。
(1)磷元素的原子結構示意圖是 。
(2)磷酸鈣與焦炭、石英砂混合,在電爐中加熱到1500°C生成白磷,反應為:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4 時,就有 mol電子發生轉移。
(3)硫代硫酸鈉(Na2S2O2)是常用的還原劑。在維生素C(化學式C6H8O6)的水溶液中加入過量I2溶液,使維生素 完全氧化,剩余的I2 用Na2S2O2溶液滴定,可測定溶液中維生素C的含量。發生的反應為:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定體積的某維生素C溶液中加入amolL-1I2溶液V1ml,充分反應后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.該溶液中維生素C的物質量是 mol。
(4)在酸性溶液中,碘酸鈉(KIO3)和亞硫酸鈉可發生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。某同學設計實驗如下表所示:
該實驗的目的是______;表中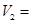 ______ML。
______ML。
II 稀土元素是寶貴的戰略資源,我國的蘊藏量居世界首位。
(5)缽(Ce)是地殼中含量最高的稀土元素,在加熱條件下CeCl3易發生水解,無水CeCl3,可用加熱CeCl3• 6H2O和NH4Cl固體混合物的方法來制備。其中,NH4Cl的作用是___________。
(6)在某強酸性混合稀土溶液中加入H2O2,調節pH ≈3. Ce5+通過下列反應形成Ce
(OH)4沉淀得以分離。完成反應的離子方程式:
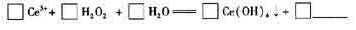
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
I.磷、硫元素的單質和化合物應用廣泛。
(1)磷元素的原子結構示意圖是 。
(2)磷酸鈣與焦炭、石英砂混合,在電爐中加熱到1500°C生成白磷,反應為:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4 時,就有 mol電子發生轉移。
(3)硫代硫酸鈉(Na2S2O2)是常用的還原劑。在維生素C(化學式C6H8O6)的水溶液中加入過量I2溶液,使維生素 完全氧化,剩余的I2 用Na2S2O2溶液滴定,可測定溶液中維生素C的含量。發生的反應為:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定體積的某維生素C溶液中加入amolL-1I2溶液V1ml,充分反應后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.該溶液中維生素C的物質量是 mol。
(4)在酸性溶液中,碘酸鈉(KIO3)和亞硫酸鈉可發生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。某同學設計實驗如下表所示:
該實驗的目的是______;表中![]() ______ML。
______ML。
II 稀土元素是寶貴的戰略資源,我國的蘊藏量居世界首位。
(5)缽(Ce)是地殼中含量最高的稀土元素,在加熱條件下CeCl3易發生水解,無水CeCl3,可用加熱CeCl3• 6H2O和NH4Cl固體混合物的方法來制備。其中,NH4Cl的作用是___________。
(6)在某強酸性混合稀土溶液中加入H2O2,調節pH ≈3. Ce5+通過下列反應形成Ce
(OH)4沉淀得以分離。完成反應的離子方程式:
查看答案和解析>>
科目:高中化學 來源:2011年普通高等學校招生全國統一考試化學卷(福建) 題型:填空題
I.磷、硫元素的單質和化合物應用廣泛。
(1)磷元素的原子結構示意圖是 。
(2)磷酸鈣與焦炭、石英砂混合,在電爐中加熱到1500°C生成白磷,反應為:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4時,就有 mol電子發生轉移。
(3)硫代硫酸鈉(Na2S2O2)是常用的還原劑。在維生素C(化學式C6H8O6)的水溶液中加入過量I2溶液,使維生素 完全氧化,剩余的I2 用Na2S2O2溶液滴定,可測定溶液中維生素C的含量。發生的反應為:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定體積的某維生素C溶液中加入amolL-1I2溶液V1ml,充分反應后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.該溶液中維生素C的物質量是 mol。
(4)在酸性溶液中,碘酸鈉(KIO3)和亞硫酸鈉可發生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。某同學設計實驗如下表所示:
該實驗的目的是______;表中 ______ML。
______ML。
II稀土元素是寶貴的戰略資源,我國的蘊藏量居世界首位。
(5)缽(Ce)是地殼中含量最高的稀土元素,在加熱條件下CeCl3易發生水解,無水CeCl3,可用加熱CeCl3? 6H2O和NH4Cl固體混合物的方法來制備。其中,NH4Cl的作用是___________。
(6)在某強酸性混合稀土溶液中加入H2O2,調節pH ≈3. Ce5+通過下列反應形成Ce
(OH)4沉淀得以分離。完成反應的離子方程式: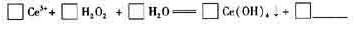
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com