
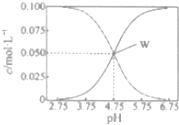
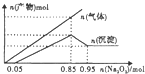
 25℃時,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一組醋酸、醋酸鈉混合溶液,溶液中c(CH2COOH)、c(CH2COO-)與pH的關系如圖所示.下列有關溶液中離子濃度關系的敘述不正確的是( )
25℃時,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一組醋酸、醋酸鈉混合溶液,溶液中c(CH2COOH)、c(CH2COO-)與pH的關系如圖所示.下列有關溶液中離子濃度關系的敘述不正確的是( )| A. | 25℃時,醋酸的電離常數Ka=1×10-4.75 | |
| B. | W點所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
分析 根據圖象可看出,濃度增大的曲線應為c(CH3COO-),濃度減小的曲線應為c(CH3COOH),W點時c(CH3COOH)=c(CH3COO-),
A.根據電離平衡常數公式解答;
B.結合溶液的電荷守恒、物料守恒判斷;
C.根據圖象結合溶液pH分析;
D.根據電荷守恒、物料守恒判斷.
解答 解:A.W點c(CH3COOH)=c(CH3COO-),平衡常數K=$\frac{c(C{H}_{3}CO{O}^{-}).C({H}^{+})}{C(C{H}_{3}COOH)}$=10-4.75mol•L-1,故A正確;
B.由圖可知,W點所表示的溶液中c(CH3COOH)=c(CH3COO-)=0.05mol/L,溶液中電荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)+c(H+)=c(CH3COOH)+c(OH-),故B正確;
C.根據圖象知,pH=5.5溶液中:c(CH3COOH)<c(CH3COO-),故C錯誤;
D.由電荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(OH-)-c(OH-)+c(CH3COOH)=0.1mol/L,故D正確.
故選C.
點評 本題考查了離子濃度大小比較,側重于學生的分析能力的考查,溶液中存在水解與電離兩個過程的離子濃度大小比較似乎是考試熱點內容,再結合守恒思想分析解答,題目難度中等.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨反應在低溫下能夠自發進行,是因為反應物鍵能之和大于生成物鍵能之和 | |
| B. | 元素分析儀可以確定物質中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光譜可以確定物質中含有哪些金屬元素 | |
| C. | 人們利用元素周期律在過渡元素中尋找各種性能優良的催化劑,以降低化學反應的活化能,從而起到很好的節能效果 | |
| D. | 超高分辨率熒光顯微鏡能夠觀察到納米尺度的物質,用它可以獲得蛋白質溶液中的分子圖象 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 亞磷酸(H3PO3)可用作檢測汞、金、銀、鉛、碘酸等的分析試劑.
亞磷酸(H3PO3)可用作檢測汞、金、銀、鉛、碘酸等的分析試劑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
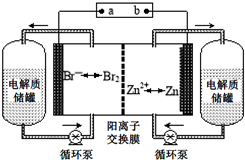 鋅溴液流電池是一種新型電化學儲能裝置(如圖所示),電解液為溴化鋅水溶液,電解質溶液在電解質儲罐和電池間不斷循環.下列說法不正確的是( )
鋅溴液流電池是一種新型電化學儲能裝置(如圖所示),電解液為溴化鋅水溶液,電解質溶液在電解質儲罐和電池間不斷循環.下列說法不正確的是( )| A. | 放電時左側電解質儲罐中的離子總濃度增大 | |
| B. | 充電時電極a連接電源的負極 | |
| C. | 放電時負極的電極反應式為Zn-2e-═Zn2+ | |
| D. | 陽離子交換膜可阻止Br2與Zn直接發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述元素中,Y的原子半徑最大 | |
| B. | 上述元素中,W的氣態氫化物最穩定 | |
| C. | 元素W和X可形成含有極性鍵的極性分子WX3 | |
| D. | 工業上可用電解熔融的Y、Z的化合物的方法冶煉Y、Z的單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合溶液中m(Al3+)為5.4g | B. | 混合溶液中c(Mg2+)為0.5mol/L | ||
| C. | 混合溶液的pH=2 | D. | 混合溶液中c(Cl-)為1.7mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 正丁烷和異丁烷互為同分異構體 | |
| B. | 乙醇和乙酸都能與氫氧化鈉溶液反應 | |
| C. | 淀粉和蛋白質的水解產物都是氨基酸 | |
| D. | 葡萄糖和蔗糖都能發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
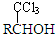 (-R表示烴基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸鉀
(-R表示烴基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸鉀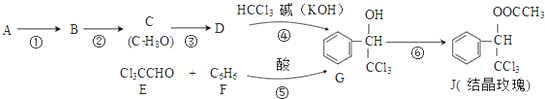
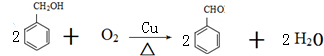 .
.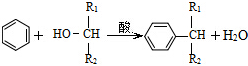 ,則經反應路線⑤得到一種副產物,其核磁共振氫譜有4種峰,各組吸收峰的面積之比為1:2:4:4.
,則經反應路線⑤得到一種副產物,其核磁共振氫譜有4種峰,各組吸收峰的面積之比為1:2:4:4.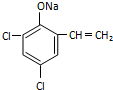 或
或 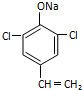 (只寫一種).
(只寫一種).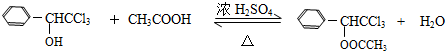 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com