
下列各表述與示意圖一致的是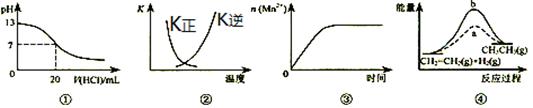
| A.圖①表示25℃時,用0.1mol?L-1鹽酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH隨加入酸體積的變化 |
B.圖②曲線表示反應2SO2(g)+O2(g) 2SO3(g);△H﹤0正、逆反應的平衡常數K隨溫度的變化 2SO3(g);△H﹤0正、逆反應的平衡常數K隨溫度的變化 |
| C.圖③表示10mL0.01mol?L-1KMnO4酸性溶液與過量的0.1mol?L-1H2C2O4溶液混合時,n(Mn2+)隨時間的變化 |
| D.圖④中a、b曲線分別表示反應CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化劑時,反應過程中的能量變化 |
B
解析試題分析:A.用0.1mol?L-1鹽酸滴定20mL0.1mol?L-1NaOH溶液,當達到滴定終點時溶液的pH會有大的突越,錯誤;B.反應2SO2(g)+O2(g) 2SO3(g);△H﹤0的正反應是放熱反應,則逆反應是吸熱反應,當升高溫度時,平衡逆向移動,正反應平衡常數減小;逆反應的平衡常數K增大,二者互為倒數,正確;C.圖③表示用10mL0.01mol?L-1KMnO4酸性溶液滴定過量的0.1mol?L-1H2C2O4溶液混合時,n(Mn2+)隨時間的變化,錯誤;D.由于該反應是放熱反應,反應物的能量比生成物的能量高,所以圖④中a、b曲線不能表示反應CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化劑時,反應過程中的能量變化,錯誤。
2SO3(g);△H﹤0的正反應是放熱反應,則逆反應是吸熱反應,當升高溫度時,平衡逆向移動,正反應平衡常數減小;逆反應的平衡常數K增大,二者互為倒數,正確;C.圖③表示用10mL0.01mol?L-1KMnO4酸性溶液滴定過量的0.1mol?L-1H2C2O4溶液混合時,n(Mn2+)隨時間的變化,錯誤;D.由于該反應是放熱反應,反應物的能量比生成物的能量高,所以圖④中a、b曲線不能表示反應CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化劑時,反應過程中的能量變化,錯誤。
考點:考查圖像法在表示酸堿中和滴定、反應中的能量變化、微粒的濃度、平衡常數與溫度關系的知識。


科目:高中化學 來源: 題型:實驗題
(10分)實驗室利用如圖裝置進行中和熱的測定。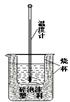
回答下列問題:①如圖裝置中,為了酸堿能更充分地反應,應該增加一個 (填玻璃儀器名稱);大燒杯上沒有蓋上硬紙板,測得的中和熱數值將會 (填“偏大”、“偏小”或“無影響”)。
②在操作正確的前提下提高中和熱測定的準確性的關鍵是 ( 填代號)
A.進行實驗時的氣溫 B.裝置的保溫隔熱效果 C.實驗所用酸堿溶液的體積
③如果用0.5 mol/L的鹽酸和氫氧化鈉固體進行實驗,則實驗中所測出的“中和熱”的數值將 (填“偏大”、“偏小”、“不變”);原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在反應2SO2+O2 2SO3中,有a mol SO2和b mol O2參加反應,達到化學平衡狀態時有c mol SO3生成,則SO2在平衡混合物中的體積分數為
2SO3中,有a mol SO2和b mol O2參加反應,達到化學平衡狀態時有c mol SO3生成,則SO2在平衡混合物中的體積分數為
A.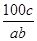 ×100% ×100% | B.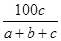 ×100% ×100% |
C.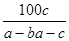 ×100% ×100% | D.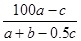 % % |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在溶液中,CaCl2+CO2+H2O=CaCO3↓+2HCl在任何條件下都不能發生,原因是該反應的( )
| A.△H >0ΔS>0 | B.△H<0ΔS<0 | C.△H<0 ΔS>0 | D.△H >0ΔS<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知有反應:I2(g)+H2(g) 2HI(g)△H<0,該反應在恒容的密閉容器中達到平衡后,若僅改變圖中x的值,則y隨x變化趨勢合理的是
2HI(g)△H<0,該反應在恒容的密閉容器中達到平衡后,若僅改變圖中x的值,則y隨x變化趨勢合理的是
| 選項 | X | Y |  |
| A | 溫度 | 容器內混合氣體的密度 | |
| B | I2的物質的量 | H2的轉化率 | |
| C | H2的濃度 | 平衡常數K | |
| D | 加入Ar的物質的量 | 逆反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于化學反應限度的說法正確的是( )
| A.當一個可逆反應達到平衡狀態時,這就是這個反應所能達到的限度 |
| B.當一個可逆反應進行到平衡狀態時,這個反應的正向反應速率和逆向反應速率相等 |
| C.平衡狀態是一種靜止的狀態,因為反應物和生成物的濃度已經不再改變 |
| D.化學反應的限度不可以通過改變條件而改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知某反應aA(g)+bB(g)?==?cC(g)的各物質濃度數據如下:
| | A | B | C |
| 起始濃度(mol·L-1) | 3.0 | 1.0 | 0 |
| 2 s末濃度(mol·L-1) | 1.8 | 0.6 | 0.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定溫度下,某一恒容密閉容器內有可逆反應:A(g)+3B(g) 2C(g),該反應進行到一定限度后達到化學平衡的標志是
2C(g),該反應進行到一定限度后達到化學平衡的標志是
A.單位時間內生成a mol物質A,同時生成3a mol物質B
B.物質C的生成速率和分解速率相等
C.容器內氣體的密度不再隨時間而改變
D.物質A、B、C的分子數之比為1∶3∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com