
分析 (1)硫元素含量=FeS2的含量×FeS2中S元素質量分數;
(2)根據方程式計算生成二氧化硫的體積;
(3)設FeS2為1 mol,計算完全煅燒需要的n(O2)、生成的n(SO2),結合空氣中氧氣含量計算過量20%所需空氣物質的量,計算爐氣的物質的量,進而計算SO2體積分數;
(4)bmol空氣所含氧氣為:n (O2)=0.2bmol,根據S原子守恒計算SO2的物質的量,根據O原子守恒計算固體中O原子物質的量,再結合固體中Fe、O原子數目之比計算.
解答 解:(1)硫元素含量=FeS2的含量×FeS2中S元素質量分數,故FeS2的含量為$\frac{35%}{\frac{64}{120}}$=65.6%,
故答案為:65.6%;
(2)設生成二氧化硫的體積為V m3,則:
4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2
480g 8×22.4L
106g 1000V L
故480g:106g=8×22.4L:1000V L
解得V=373.3,
故答案為:373.3;
(3)設FeS2為1 mol,由4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2 可知,完全煅燒需要的n(O2)=1mol×$\frac{11}{4}$=2.75 mol,生成n(SO2)=2 mol;
過量20%所需空氣為:n(空氣)=2.75mol÷0.2×1.2=16.5 mol,
SO2體積分數為:SO2%=2mol÷(16.5+2-2.75)mol=12.7%,
答:所得爐氣中SO2的體積分數為12.7%;
(4)bmol空氣所含氧氣為:n (O2)=0.2bmol;480 g純凈的FeS2為$\frac{480g}{120g/mol}$=4mol,完全反應生成8molSO2,故存在于固體中的n (O)=(0.2b-8)×2mol,則:n (Fe):n (O)=4:a=4:(0.2b-8)×2,故b=2.5a+40,
故答案為:b=2.5a+40.
點評 本題考查化學方程式計算,側重考查學生的分析計算能力,注意對基礎知識的理解掌握,難度不大.


 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用托盤天平稱量藥品時,將藥品置于天平右盤 | |
| B. | 蒸餾實驗中,要在燒瓶中加入沸石或碎瓷片,以防止液體暴沸 | |
| C. | 用托盤天平稱取10.50g干燥的NaCl固體 | |
| D. | 向沸騰的NaOH稀溶液中滴加FeCl3飽和溶液,以制備Fe(OH)3膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.18 g | B. | 2.12 g | C. | 4.22 g | D. | 5.28 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他條件不變,若增加液氨的量,電離平衡將正向移動 | |
| C. | 只要不加入其他物質,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定溫度下液氨中c(NH4+)•c(NH2-)是一個常數 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
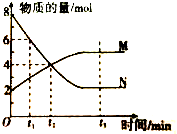 在一定溫度下,容器內某一反應中的M、N的物質的量隨反應時間變化的曲線如圖,下列表述中正確的是( )
在一定溫度下,容器內某一反應中的M、N的物質的量隨反應時間變化的曲線如圖,下列表述中正確的是( )| A. | t2時,正逆反應速率相等 | B. | t1時,N的濃度是M濃度的2倍 | ||
| C. | t3時,正反應速率大于逆斥速率 | D. | t3時,正反應速率等于逆反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
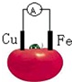
| A. | 銅片為負極 | B. | 鐵片上發生還原反應 | ||
| C. | 電子由鐵片沿導線流向銅極 | D. | 該裝置將電能轉變為化學能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  濃硫酸的稀釋 | |
| B. | 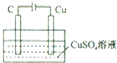 某電極上有銅產生,且溶液中銅離子濃度不變 | |
| C. | 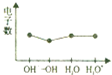 微粒電子數 | |
| D. |  過量的鹽酸與等量的鋅粉反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com