
| 元素代號 | A | B | C | D | E | G | L | I |
| 原子半徑/nm | 0.111 | 0.064 | 0.117 | 0.16 | 0.066 | 0.070 | 0.104 | 0.077 |
| 主要化合價 | +2 | -1 | +4,-4 | +2 | -2 | +5.-3 | +6,-2 | +4,-4 |
 ,N元素的氫化物為NH3,空間構型為三角錐型,
,N元素的氫化物為NH3,空間構型為三角錐型, ;三角錐型;
;三角錐型;

 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:閱讀理解
《物質結構與性質》模塊試題
1.下表是元素周期表的一部分。表中所列的字母分別代表一種化學元素。

試回答下列問題:
(1)請寫出元素o的基態原子電子排布式 ① 。
(2)d的氫化物的分子構型為 ② ,中心原子的雜化形式為 ③ ;k在空氣中燃燒產物的分子構型為 ④ ,中心原子的雜化形式為 ⑤ ,該分子是 ⑥ (填“極性”或“非極性”)分子。
(3)第三周期8種元素按單質熔點高低的順序如下圖,其中序號“8”代表 ⑦ (填元素符號);其中電負性最大的是 ⑧ (填下圖中的序號)。

(4)由j原子跟c原子以1∶1相互交替結合而形成的晶體,晶型與晶體j相同。兩者相比熔點更高的是 ⑨ ,試從結構角度加以解釋: ⑩ 。
(5)i單質晶體中原子的堆積方式如下圖甲所示,其晶胞特征如下圖乙所示,原子之間相互位置關系的平面圖如下圖丙所示。

若已知i的原子半徑為d,NA代表阿伏加德羅常數,i的相對原子質量為M,請回答:
①晶胞中i原子的配位數為![]() ,一個晶胞中i原子的數目為
,一個晶胞中i原子的數目為![]() 。
。
②該晶體的密度為![]() (用字母表示)。
(用字母表示)。
2.有A、B、C、D、E、F、G七種元素,除E為第四周期元素外其余均為短周期元素。A、E、G位于元素周期表的s區,其余元素位于p區,A、E的原子外圍電子層排布相同,A的原子中沒有成對電子;B元素基態原子中電子占據三種能量不同的原子軌道且每種軌道中的電子總數相同;C元素原子的外圍電子層排布式為nsnnpn+1;D元素的第一電離能列同周期主族元素第三高;F的基態原子核外成對電子數是成單電子數的3倍;G的基態原子占據兩種形狀的原子軌道,且兩種形狀軌道中的電子總數均相同。回答下列問題:
(1)寫出下列元素的符號:D ① ,G ② 。
(2)D的前一元素第一電離能高于D的原因: ③ 。
(3)由A、B、C形成的ABC分子中,含有 ④ 個σ鍵, ⑤ 個π鍵。
(3)由D、E、F、G形成的鹽E2DF4、GDF4的共熔體在冷卻時首先析出的物質是 ⑥ (寫化學式),原因是 ⑦ 。
《有機化學基礎》模塊試題
3.M5纖維是近年來開發出的一種超高性能纖維,它比現有的防爆破材料輕35%,用它制成的頭盔、防彈背心和剛性前后防護板,在戰爭中保住了很多士兵的生命,M5纖維是線型結構且又有分子間氫鍵的聚合物,在三維方向x、y、z上,當方向z是聚合物主鏈方向時,在x方向和y方向上的氫鍵是其晶體結構的特征。下面是M5纖維的合成路線(部分反應未注明條件):

請回答:
(1)合成M5的單體的結構簡式:F ① ,G ② 。
(2)反應類型:A![]() B: ③ ,B
B: ③ ,B![]() C: ④ 。
C: ④ 。
(3)生成A的同時可能生成的A的同分異構體: ⑤ 。
(4)寫出化學反應方程式:C![]() 對苯二甲酸: ⑥ ;D
對苯二甲酸: ⑥ ;D![]() E: ⑦ 。
E: ⑦ 。
(5)1 mol的F與NaHCO3溶液反應,最多耗NaHCO3 ⑧ mol。
(6)M5纖維分子間為什么會有氫鍵?請分析說明: ⑨ 。
4.現有A、B、C、D四種有機物,已知:它們的相對分子質量都是104;A是芳香烴,B、C、D均為烴的含氧衍生物,四種物質分子內均沒有甲基;A、B、C、D能發生如下反應生成高分子化合物X、Y、Z(反應方程式未注明條件):
①nA![]() X ②nB
X ②nB![]() Y(聚酯)+nH2O ③nC+nD
Y(聚酯)+nH2O ③nC+nD![]() Z(聚酯)+2nH2O
Z(聚酯)+2nH2O
請按要求填空:
(1)A的結構簡式是 ① ,Z的結構簡式是 ② 。
(2)在A中加入少量溴水并振蕩,所發生反應的化學方程式: ③ 。
(3)B的同分異構體有多種,其中分子中含結構![]() 的同分異構體的結構簡式分別是 ④ 。
的同分異構體的結構簡式分別是 ④ 。
查看答案和解析>>
科目:高中化學 來源:2010年山東省濰坊市高三上學期開學摸底考試化學試題 題型:填空題
(選做題)(21分)下表是元素周期表的一部分,表中所列的字母分別代表一種化學元素。
試回答下列問題:
(1)元素p為26號元素,請寫出其基態原子電子排布式 。
(2)d與a反應的產物的分子中中心原子的雜化形式為 。
(3)h的單質在空氣中燃燒發出耀眼的白光,請用原子結構的知識解釋發光的原因: 。
(4)o、p兩元素的部分電離能數據列于表:
| 元素 | o | P | |
| 電離能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

 鍵, 個
鍵, 個 鍵。
鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)下表是元素周期表的一部分。表中所列的字母分別代表某一種化學元素。
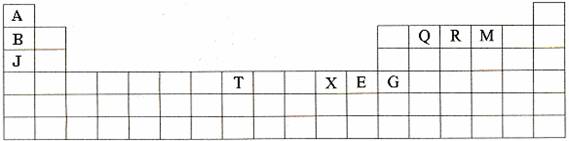
(1)T3+的核外電子排布式是: 。
(2)Q、R、M的第一電離能由大到小的順序是 (用元素符號表示)。
(3)下列有關上述元素的說法中,正確的是: (填序號)。
①B單質的熔點高于J單質,是因為B單質的金屬鍵較強
②J比X活潑,所以J可以在溶液中置換出X
③將J2M2溶于水,要破壞離子鍵和共價鍵
④RA3沸點高于QA4,主要是因為前者相對分子質量較大
⑤一個Q2A4分子中含有五個σ鍵和一個![]() 鍵
鍵
(4)加拿大天文臺在太空發現了AQ9R,已知分子中所有原子均形成8電子或2電子穩定結構,是直線型分子,不存在配位鍵。寫出其結構式: 。
(5)B與R單質直接化合生成一種離子化合物B3R。該晶體具有類似石墨的層狀結構。每層中,B原子構成平面六邊形,每個六邊形的中心有一個R原子。層與層之間還夾雜一定數量的原子。請問這些夾雜的原子應該是 (填B或R的元素符號)。
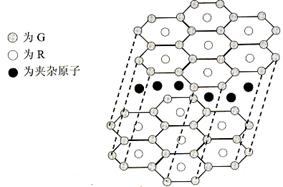
(6)元素周期表中第四周期元素由于受3d電子的影響,性質的遞變規律與短周期元素略有不同。第四周期元素的第一電離能隨原子序數的增大,總趨勢是逐漸增大的。但G的第一電離能卻明顯低于E,原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
(12分)下表中所列的是8種短周期元素原子的半徑及主要化合價:
(1)C元素在周期表中的位置為 ▲ ;IE2的電子式為 ▲ ,G元素最低價氫化物的空間構型為 ▲ 。
(2)B、D、E所代表元素的離子半徑從大到小的順序為 ▲ (填離子符號)。G、C最高價氧化物對應水化物的酸性強弱關系為(寫化學式) ▲ 。
(3)C與E形成的化合物屬于 ▲ 晶體。
(4)周期表中有些元素存在“對角線相似”現象(一種元素的性質常同它右下方相鄰的另一種元素具有類似性),請寫出A的單質與強堿溶液反應的離子方程式: ▲ 。
(5)有人認為:H—E鍵的鍵能大于H—L鍵的鍵能,所以H2E的沸點高于H2L的沸點。你是否贊同這種觀點 ▲ (填“贊同”或“不贊同”),理由: ▲ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com