
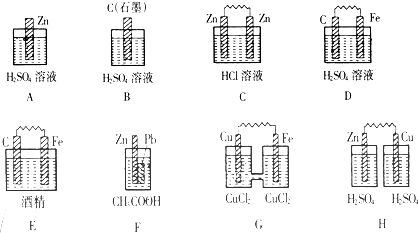
Ⅰ.在下圖的裝置中,屬于原電池的是 。

Ⅱ.(1)如圖所示,燒杯中為CuCl2溶液,在圖中畫出必要的連線或裝置,使連接后的裝置為原電池。電極反應方程式:

鐵板: ;碳棒: 。
(2)銅片、鋅片連接后浸入稀硫酸中構成原電池,當導線上通過3.01×1022個電子時,鋅片質量減少________g。銅片表面析出氫氣_________L(標準狀況)。
Ⅰ.D、F、G Ⅱ.(1)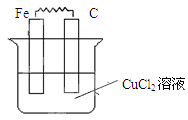 Fe-2e-=Fe2+
Cu2++2e-=Cu
Fe-2e-=Fe2+
Cu2++2e-=Cu
(2)1.625g 0.56L
【解析】
試題分析:Ⅰ.原電池的構成條件是:①有兩個活潑性不同的電極,②將電極插入電解質溶液中,③兩電極間構成閉合回路,④能自發的進行氧化還原反應,據此可知:
A、該裝置只有一個電極材料,所以不能形成原電池;
B、該裝置只有一個電極材料,且石墨和電解質溶液不能自發的進行氧化還原反應,所以不能形成原電池;
C、兩電極材料相同,所以不能形成原電池,故錯誤;
D、該裝置符合原電池的構成條件,所以能形成原電池,故正確;
E、酒精不是電解質,鐵和酒精不能自發的進行氧化還原反應,所以不能形成原電池;
F、該裝置符合原電池的構成條件,所以能形成原電池,故正確;
G、該裝置符合原電池的構成條件,所以能形成原電池,故正確;
H、該裝置兩電極間不能構成閉合回路,所以不能形成原電池,所以答案選D、F、G
Ⅱ.(1)原電池中較活潑的金屬是負極,失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應。鐵是活潑的金屬,所以鐵是負極,碳棒是正極,溶液中的銅離子再正極得到電子,發生還原反應,電極反應式分別是Fe-2e-=Fe2+、Cu2++2e-=Cu。
(2)銅片、鋅片連接后浸入稀硫酸中構成原電池,其中鋅是負極,銅是正極,電極反應式分別是Zn-2e-=Zn2+、2H++2e-=H2↑。3.01×1022個電子的物質的量是3.01×1022÷6.02×1023/mol=0.05mol,所以鋅片質量減少0.025mol×65g/mol=1.625g,銅片表面析出氫氣的體積(標準狀況下)是0.025mol×22.4L/mol=0.56L。
考點:考查原電池構成條件的判斷、電極反應式的書寫以及有關計算等
點評:該題是高考中的常見考點,側重對學生基礎知識的鞏固和訓練。有利于培養學生的邏輯推理能力和規范答題能力。明確原電池的工作原理、構成條件是答題的關鍵,注意相關知識的積累和總結。


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com