
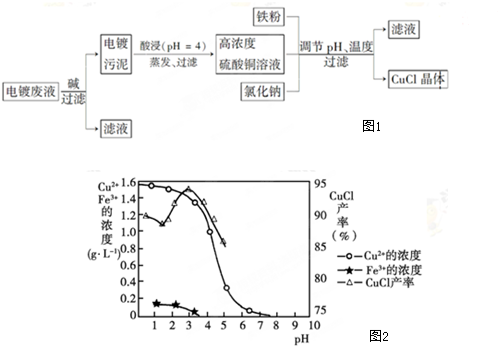
分析 電鍍廢液中加入堿可生成Cu(OH)2、Fe(OH)3沉淀,在pH約為4時,用酸浸得到硫酸銅溶液和氫氧化鐵沉淀,在硫酸銅溶液中加入氯化鈉、鐵,發生氧化還原反應生成CuCl,發生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得濾液為硫酸亞鐵,結合CuCl的性質和題目要求解答該題.
(1)在pH約為4時,用酸浸得到硫酸銅溶液和氫氧化鐵沉淀,說明氫氧化銅被酸溶解,由圖2可知,析出CuCl沉淀的最佳pH應為CuCl的產率最大,且氫氧化鐵雜質較少,應約為3左右;
(2)在硫酸銅溶液中加入氯化鈉、鐵,發生氧化還原反應生成CuCl,發生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,故答案為:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由題給信息可知CuCl微溶于水,不溶于乙醇,在空氣中會被迅速氧化,為防止氧化應隔絕空氣,在干燥、真空環境中可加快乙醇和水的蒸發;
(4)產品濾出時所得濾液的主要分成是Na2SO4和FeSO4;獲取FeSO4•7H2O晶體,還需要知道的是硫酸鈉和硫酸亞鐵溶解度隨溫度的變化的情況;
(5)若將鐵粉換成亞硫酸鈉是亞硫酸鈉作為還原劑,失電子,反應方程式為:2 CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4,加入稀堿溶液消耗氫離子,從平衡正向移動,有利于氯化亞銅的產生,而當氫氧根離子濃度大到一定程度時以達到氫氧化銅的溶度積分析解答.
解答 解:(1)在pH約為4時,用酸浸得到硫酸銅溶液和氫氧化鐵沉淀,說明氫氧化銅被酸溶解,反應的離子方程式為Cu(OH)2+2H+=Cu2++2H2O,由圖2可知,析出CuCl沉淀的最佳pH應為CuCl的產率最大,且氫氧化鐵雜質較少,應約為3左右,故答案為:Cu(OH)2+2H+=Cu2++2H2O;3;
(2)在硫酸銅溶液中加入氯化鈉、鐵,發生氧化還原反應生成CuCl,發生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,故答案為:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由題給信息可知CuCl微溶于水,不溶于乙醇,在空氣中會被迅速氧化,為防止氧化應隔絕空氣,在干燥、真空環境中可加快乙醇和水的蒸發,
故答案為:加快乙醇和水的蒸發,防止CuCl被空氣氧化;
(4)產品濾出時所得濾液的主要分成是Na2SO4和FeSO4;獲取FeSO4•7H2O晶體,還需要知道的是硫酸鈉和硫酸亞鐵溶解度隨溫度的變化的情況,
故答案為:Na2SO4和FeSO4;不同溫度下硫酸鈉和硫酸亞鐵的溶解度;
(5)亞硫酸鈉作為還原劑,失電子,發生氧化還原反應,反應方程式為:2 CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4,加入稀堿溶液消耗氫離子,從平衡正向移動,有利于氯化亞銅的產生,而當氫氧根離子濃度大到一定程度時以達到氫氧化銅的溶度積,所以又析出氫氧化銅,所以調節pH至3.5,
故答案為:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4;OH-中和了反應中的H+,有利于平衡向右移動,提高CuCl的產率.但當OH-濃度過大時,Cu+能與OH-結合,生成氫氧化亞銅,從而降低了CuCl的產率.
點評 本題考查制備方案的設計,側重于學生的分析能力和實驗能力的考查,注意把握題給信息,答題時注意審題,把握自學能力的培養,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | H2NCONH2與H2O2是通過氫鍵結合的 | B. | H2O2分子中只含σ鍵,不含π鍵 | ||
| C. | H2O2既有氧化性又有還原性 | D. | H2NCONH2•H2O2屬于離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
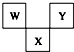 如圖是周期表中短周期的一部分,W、X、Y三種元素原子核外電子數之和等于X的質量數,X原子核內質子數和中子數相等.下列敘述中不正確的是( )
如圖是周期表中短周期的一部分,W、X、Y三種元素原子核外電子數之和等于X的質量數,X原子核內質子數和中子數相等.下列敘述中不正確的是( )| A. | 三種元素的原子半徑的大小順序是W<Y<X | |
| B. | W最高價氧化物對應水化物具有強酸性,氣態氫化物的水溶液具有弱堿性 | |
| C. | X元素的氧化物、氫化物的水溶液都呈酸性 | |
| D. | Y元素的單質是非金屬單質中唯一能跟水發生劇烈反應的單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4 | B. | C4H8 | C. | (CH3)2C=CHCH2CH3 | D. | CH2=CHCH2CH=CH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化氫溶于水能電離出H+、Cl-,所以氯化氫是離子化合物 | |
| B. | 碘晶體受熱轉變成碘蒸氣,吸收的熱量用于克服碘原子間的作用力 | |
| C. | 有機化合物CH3-CH2-NO2和H2N-CH2-COOH是同分異構體 | |
| D. | 加熱鋁使之熔化克服的是共價鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com