
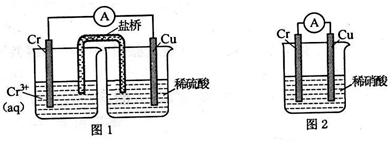
 鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各 種性能的不銹鋼,CrO3大量地用于電鍍工業中.
鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各 種性能的不銹鋼,CrO3大量地用于電鍍工業中.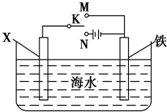 ,可以模擬鐵的電化學防護.若 X 為碳棒,為減緩鐵的腐蝕,開關 K 應置于N處.若 X 為鋅,開關K 置于N或M處.
,可以模擬鐵的電化學防護.若 X 為碳棒,為減緩鐵的腐蝕,開關 K 應置于N處.若 X 為鋅,開關K 置于N或M處.分析 (1)圖1裝置銅電極上產生大量的無色氣泡,說明Cr的活潑性大于Cu,而圖 2裝置中銅電極上無氣體產生,鉻電極上產生大量有色氣體,說明Cr為正極、Cu為負極,則Cr和硝酸能產生鈍化現象,正極上硝酸根離子得電子發生還原反應;
(2)由題目信息可知,CrO3、C2H5OH、H2SO4反應生Cr2(SO4)3、CH3COOH,同時還有水生成,配平書寫方程式;
(3)為減緩鐵的腐蝕,形成原電池時Fe作正極,形成電解池時Fe作陰極;
(4)根據Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)、Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)計算c(Cr3+).
解答 解:(1)圖1裝置銅電極上產生大量的無色氣泡,說明Cr的活潑性大于Cu,而圖 2裝置中銅電極上無氣體產生,鉻電極上產生大量有色氣體,說明Cr為正極、Cu為負極,則Cr和硝酸能產生鈍化現象,正極上硝酸根離子得電子發生還原反應生成NO,電極反應式為:NO3-+4H++3e-=NO↑+2H2O,
故答案為:NO3-+4H++3e-=NO↑+2H2O;
(2)由題目信息可知,CrO3、C2H5OH、H2SO4反應生Cr2(SO4)3、CH3COOH,同時還有水生成,反應方程式為:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案為:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3)若 X 為碳棒,開關 K 應置于M處,構成原電池,Fe為負極,加速Fe的腐蝕,開關 K 應置于N處,構成原電池,Fe為陰極,被保護,減緩鐵的腐蝕,
若 X 為鋅,開關 K 應置于M處,構成原電池,Zn為負極,Fe被保護,減緩鐵的腐蝕,開關 K 應置于N處,構成原電池,Fe為陰極,被保護,減緩鐵的腐蝕,
故答案為:N;N或M;
(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.0×10-6×c3(OH-)=3.0×10-31,
Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-38
聯立可得c(Cr3+)=4.0×10-13mol/L,
故答案為:4.0×10-13.
點評 本題考查較綜合,涉及電化學知識、氧化還原反應、溶度積有關計算等,較好的考查學生信息獲取與加工能力及圖象分析能力、知識遷移運用能力,題目難度中等.


 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 實驗現象 | 實驗結論 | |
| A | 向未知液中滴加氯水,再滴加KSCN溶液 | 溶液呈紅色 | 未知液中一定含有Fe2+ |
| B | 向無色溶液中滴加氯水,再加CCl4振蕩,靜置 | 溶液分層,下層呈紫紅色 | 無色溶液中一定含I- |
| C | 某氣體通入品紅溶液中 | 紅色褪去 | 該氣體中一定含SO2 |
| D | 將豆粒大金屬鉀投入水中 | 鉀熔化成小球,在水面上游動 | 金屬鉀密度一定小于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
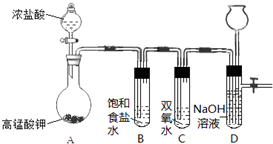 Cl2和H2O2是高中階段最常見的兩種氧化劑,經查閱資料Cl2氧化能力強于H2O2,能將H2O2氧化.為了驗證某小組學生設計了如下圖所示的實驗裝置進行實驗(夾持裝置略去).
Cl2和H2O2是高中階段最常見的兩種氧化劑,經查閱資料Cl2氧化能力強于H2O2,能將H2O2氧化.為了驗證某小組學生設計了如下圖所示的實驗裝置進行實驗(夾持裝置略去).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
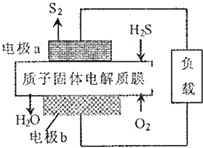 H2S利用是回收能最并得到單質硫.反應原理為:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下圖為質子膜H2S燃料電池示意圖.下列說法正確的是( )
H2S利用是回收能最并得到單質硫.反應原理為:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下圖為質子膜H2S燃料電池示意圖.下列說法正確的是( )| A. | 該電池可實現把化學能全部轉化為電能 | |
| B. | 電極b上發生的電極反應為:02+2H2O+4e-═40H- | |
| C. | 電極a上發生的電極反應為:2H2S-4e-═S2+4H+ | |
| D. | 當有34gH2S參與反應時,有2mo1H+經質子膜進人負極區 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
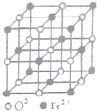 (1)PM2.5富含大量的有毒、有害物質,易引發二次光化學煙霧,光化學煙霧中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物質,易引發二次光化學煙霧,光化學煙霧中含有NOx、HCOOH、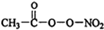 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
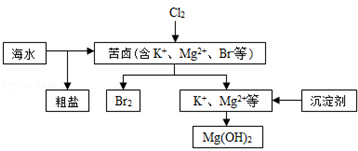
| A. | 向苦鹵中通入Cl2是為了提取溴 | |
| B. | 粗鹽可采用除雜、過濾、蒸發結晶等過程提純 | |
| C. | 工業生產常選用NaOH作為沉淀劑 | |
| D. | 單質溴可用SO2將其還原吸收 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
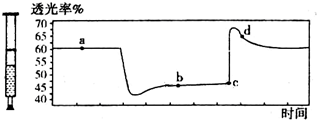 已知2NO2═N2O4+Q (Q>0),將一定量的NO2充入注射器中后封口,如圖是在拉伸和壓縮注射器的過程中氣體透光率隨時間的變化(氣體顏色越深,透光率越小).下列說法正確的是( )
已知2NO2═N2O4+Q (Q>0),將一定量的NO2充入注射器中后封口,如圖是在拉伸和壓縮注射器的過程中氣體透光率隨時間的變化(氣體顏色越深,透光率越小).下列說法正確的是( )| A. | c點的操作是拉伸注射器 | |
| B. | b點與a點相比,c(NO2)增大,c(N2O4)減小 | |
| C. | 若反應在一絕熱容器中進行,則a、b兩點的平衡常數Ka>Kb | |
| D. | d點:v(正)>v(逆) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com