設NA表示阿伏伽德羅常數,下列說法正確的是( )
A.在25℃、101kPa下,11.2L氧氣所含的原子數為NA
B.0.5molNa與足量水發生反應轉移的電子數為NA
C.20g重水(D2O)所含的電子數為10NA
D.在標準狀況下,5.6L的CCl4中所含的氯原子總數為NA
【答案】
分析:A、氣體摩爾體積v
m=22.4L/mol的使用條件是標準狀況(0℃、101kPa);
B、Na與水發生反應生成鈉離子,一個鈉原子失去一個電子生成鈉離子,所以轉移的電子數與鈉原子數相等;
C、求出重水的物質的量,由于一個重水分子中含有10個電子,再根據N(電子數)=10n(D
2O)N
A計算;
D、氣體摩爾體積v
m=22.4L/mol的使用范圍是單一氣體或能共存的混合氣體(在標準狀況下),
解答:解:A、不是標準狀況,不能使用氣體摩爾體積v
m=22.4L/mol,故A錯誤.
B、Na與水發生反應生成鈉離子,一個鈉原子失去一個電子生成鈉離子,所以轉移的電子數與鈉原子數相等,為0.5N
A,故B錯誤.
C、n(D
2O)=
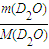
=
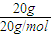
=1mol,20g重水(D
2O)所含的電子數為N(電子數)=)=10n(D
2O)N
A=10N
A,故C錯誤.
D、標況下,CCl
4是液體,氣體摩爾體積v
m=22.4L/mol不適用于該物質,所以5.6L的CCl
4中所含的氯原子總數不是N
A,故D錯誤.
故選C.
點評:本題考查了阿伏伽德羅常數的有關計算,難度不大,注意氣體摩爾體積的使用范圍和條件及重水的摩爾質量.

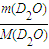 =
=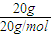 =1mol,20g重水(D2O)所含的電子數為N(電子數)=)=10n(D2O)NA=10NA,故C錯誤.
=1mol,20g重水(D2O)所含的電子數為N(電子數)=)=10n(D2O)NA=10NA,故C錯誤.
