
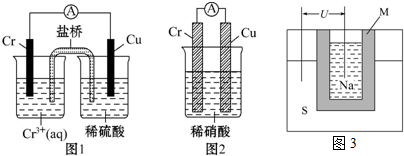
分析 (1)由圖1可知還原性Cr>Cu,但在稀硝酸中卻出現了反常,結合稀硝酸的氧化性,不難推測鉻被稀硝酸鈍化,導致活性降低;
(2)電池放電時正極的Ag2O2 轉化為Ag,負極的Zn轉化為K2Zn(OH)4,反應還應有KOH參加,依據轉化寫出電池反應;
(3)甲醇酸性燃料電池中,負極上燃料失電子發生氧化反應,正極上氧氣得電子發生還原反應;
(4)正極上得電子發生還原反應;熔融狀態下,Na2O和Al2O3能電離出陰陽離子而使電解質導電,且鈉易和硫反應;根據轉移電子和負極質量的關系分析.
解答 解:(1)由圖1可知還原性Cr>Cu,但在稀硝酸中卻出現了反常,結合稀硝酸的氧化性,不難推測鉻被稀硝酸鈍化,導致活性降低,
故答案為:金屬鉻的活動性比銅的強且能和稀硫酸反應生成H2;金屬鉻易被稀硝酸鈍化;
(2)電池放電時正極的Ag2O2 轉化為Ag,負極的Zn轉化為K2Zn(OH)4,正極電極反應式為Ag2O2+4e-+2H2O═2Ag+4OH-,負極電極反應式為2Zn-4e-+8OH-═2Zn(OH)42-,反應還應有KOH參加,反應的總方程式為:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag;
故答案為:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag;
(3)甲醇燃料電池中,負極上甲醇失電子發生氧化反應,電極反應式為CH3OH+H2O-6e-═CO2+6H+,正極上氧氣得電子發生還原反應,電極反應式為$\frac{3}{2}$O2+6H++6e-═3H2O,
故答案為:CH3OH+H2O-6e-═CO2+6H+;$\frac{3}{2}$O2+6H++6e-═3H2O;
(4)正極上硫得電子發生還原反應,所以正極電極反應式為:xS+2e-═Sx2-,熔融狀態下,Na2O和Al2O3能電離出陰陽離子而使電解質導電,且鈉易和硫反應,所以它起到隔離作用,
鈉高能電池中負極為鈉,有23g鈉消耗釋放1mol e-,則207g鈉消耗時轉移207/23mol e-,鉛蓄電池的電極反應為:Pb+PbO2+2H2SO4═2PbSO4+2H2O,鉛蓄電池中鉛是負極,207g鉛消耗時轉移 2mol e-,故鈉硫電池的理論放電量是鉛蓄電池的:207÷23÷2=4.5 倍,
故答案為:xS+2e-═Sx2-;導電和隔離鈉與硫;4.5.
點評 本題考查了原電池原理,明確正負極上得失電子及反應類型是解本題關鍵,難點是電極反應式的書寫,注意結合電解質溶液的酸堿性書寫,側重于考查學生的分析能力和計算能力.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在銅的精煉中,粗銅為陽極 | |
| B. | 銅在空氣中也容易生銹,可用稀硝酸洗滌 | |
| C. | 銅離子氧化性較強,能氧化I-,所以Cu2+與S2-反應將生成硫單質 | |
| D. | 銅金屬性比鐵弱,因此Cu2+與鐵反應生成Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
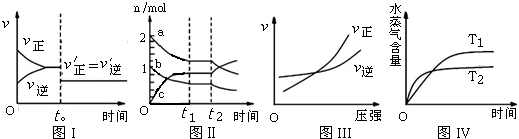
| A. | 圖I:反應H2+I2═2HI 達平衡后,t0時降低溫度反應速率隨時間的變化 | |
| B. | 圖Ⅱ:反應2SO3═2SO2+O2 達平衡后,擴大容器體積時各成分的物質的量隨時間的變化(圖中a、b、c分別代表SO2、O2、SO3的物質的量的變化曲線) | |
| C. | 圖III:反應N2+3H2═2NH3在恒溫情況下,反應速率與壓強的關系 | |
| D. | 圖IV:反應CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸氣含量隨時間的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若質量相等,則質子數一定相等 | B. | 若原子數相等,則中子數一定相等 | ||
| C. | 若分子數相等,則體積一定相等 | D. | 若密度相等,則體積一定相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入硝酸銀溶液有白色沉淀生成,證明含有氯離子 | |
| B. | 加入氯化鋇溶液有白色沉淀生成,繼續加過量的稀鹽酸,沉淀不消失,證明溶液中含有硫酸根離子 | |
| C. | 加濃氫氧化鈉溶液后加熱,產生使濕潤紅色石蕊試紙變藍的氣體,證明含有銨根離子 | |
| D. | 加入鹽酸,放出能使澄清石灰水變渾濁的無色無味氣體,證明含有碳酸根離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
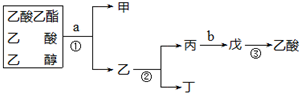
| A. | 甲是乙酸乙酯 | |
| B. | ①、②操作都是蒸餾 | |
| C. | a試劑是飽和Na2CO3溶液 | |
| D. | 制備乙酸乙酯時加試劑的順序是:乙醇、濃硫酸、乙酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com