
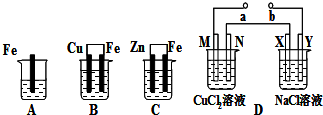
分析 (1)原電池中失電子的極是負極得電子的極是正極;
(2)金屬的腐蝕速率:原電池的負極腐蝕速率>化學腐蝕>原電池的正極腐蝕速率;
(3)根據電極反應式來計算轉移電子和消耗金屬量的關系;
(4)電解池中和電源的負極相連的是陰極,和電源的正極相連的是陽極;解池的陽極不屬于活潑電極時,電解質中的陰離子在該極發生失電子的氧化反應;
(5)串聯電路中轉移的電子數是相等的,根據電子轉移的多少來計算析出生成物的物質的量.
解答 解:A是金屬鐵直接和硫酸銅之間的反應,B是原電池,金屬鐵為負極,金屬銅為正極,C為原電池,金屬鋅是負極,金屬鐵是正極,D中在XY兩邊各滴入幾滴酚酞試液,X極附近首先變紅,說明X附近是氫離子放電了,所以X極是陰極,所以Y極是陽極,b極是電源的正極,a極是電源的負極,M極是陰極,N是陽極.
(1)B中Cu極為正極,發生銅離子得電子的還原反應,電極反應式為Cu2++2e-=Cu,故答案為:Cu2++2e-=Cu;
(2)金屬的腐蝕速率:原電池的負極腐蝕速率>化學腐蝕>原電池的正極腐蝕速率,即反應速率最快的是B,最慢的是C,所以速率由快到慢的順序為:B>A>C,故答案為:B>A>C;
(3)C中負極反應是:Zn-2e-→Zn2+,被腐蝕金屬鋅的質量是32.5g即0.5mol時,轉移電子數是1mol,故答案為:1mol;
(4)M極是陰極,a極是電源的負極,電池D中N極是陽極,氯離子發生失電子的氧化反應,電極反應式為:2Cl--2e-=Cl2↑,故答案為:負;2Cl--2e-=Cl2↑;
(5)D中在M、N、X、Y各電極上的電極反應分別為:M、Cu2++2e-→Cu,N、2Cl-→Cl2↑+2e-,X、2Cl-→Cl2↑+2e-,Y、2H++2e-→H2↑,當轉移電子的物質的量相等時,生成物的物質的量也相等,所以生成物的物質的量之比為1:1:1:1,故答案為:1:1:1:1.
點評 本題考查學生電化學中原電池和電解池的工作原理知識,可以根據所學知識進行回答,難度不大.


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 126C和146C是兩種核素 | |
| B. | 纖維素和淀粉互為同分異構體 | |
| C. | CH3COOCH2CH3和CH3CH2OOCCH3是同物質 | |
| D. | CH3CH2COOH可看成是由-C2H5和-COOH兩種基團組成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等體積硫酸鐵、硫酸銅、硫酸鉀溶液分別與足量的氯化鋇溶液反應,若生成的硫酸鋇沉淀的質量比為1:2:3,則三種硫酸鹽溶液的物質的量濃度比為1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化鉀溶液中的c(Cl-)與50 mL 1 mol•L-1的氯化鋁溶液中的c(Cl-)相等 | |
| C. | 20℃時,飽和KCl溶液的密度為1.174 g•cm-3,物質的量濃度為4.0 mol•L-1,則此溶液中KCl的質量分數為$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃時,100 g水可溶解34.2 g KCl,此時KCl飽和溶液的質量分數為34.2% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干燥的NaCl晶體不能導電,但NaCl是電解質 | |
| B. | 食鹽水能導電,所以食鹽水是電解質 | |
| C. | 三氧化硫溶于水能導電,所以三氧化硫是電解質 | |
| D. | 一種物質如果不是電解質,那么它一定是非電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2、SO2均能使品紅溶液褪色,說明二者均有氧化性 | |
| B. | 常溫下,銅片放入濃硫酸中,無明顯變化,說明銅在冷的濃硫酸中發生鈍化 | |
| C. | Fe與稀HNO3、稀H2SO4反應均有氣泡產生,說明Fe與兩種酸均發生置換反應 | |
| D. | 分別充滿HCl、NH3的燒瓶倒置于水中后液面均迅速上升,說明二者均易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 元素符號 | X | Y | Z | R | T |
| 原子半徑(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合價 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 單質與稀硫酸反應的速率快慢:R>Y>X | |
| B. | 離子半徑:T2->X2+ | |
| C. | 元素最高價氧化物對應的水化物的堿性:Y>R>X | |
| D. | 相同條件下,等物質的量的單質與氫氣化合放出能量的多少:T>Z |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com